根據歐盟官網的Novel Food清單更新動態,瑞旭就近三年Novel Food的批準情況進行了簡要統計對比(見下圖)。
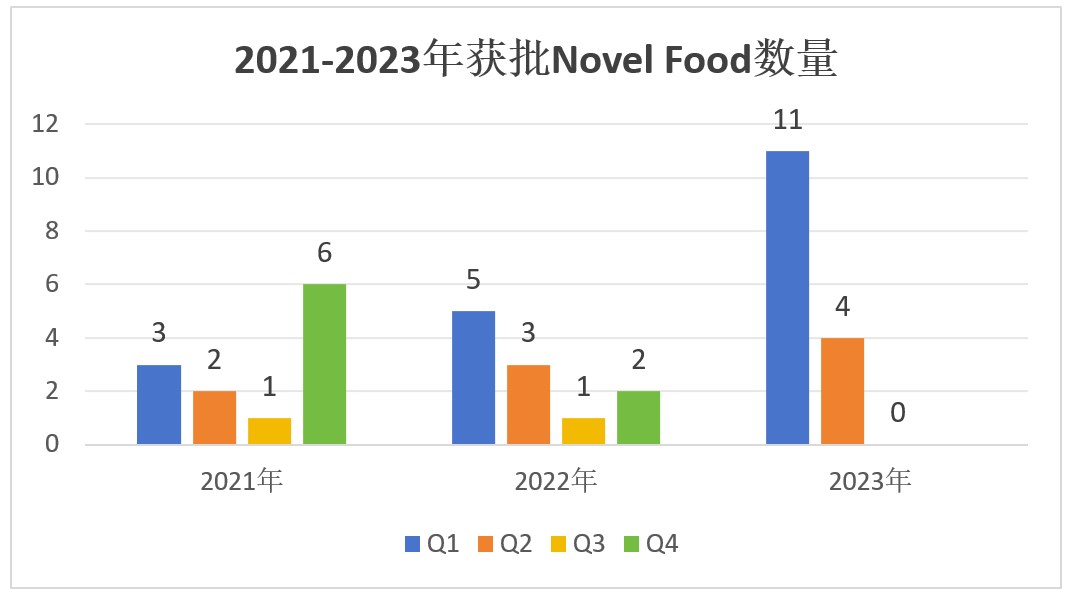
圖表數據顯示,歐盟近年在Q2批準的物質數量較為穩定,Q1和Q4波動較大,批準物質時多時少,而Q3在21年和22年均僅有1個物質獲批,今年更是出現了零批準的情況。
這次輔一進入Q4,歐盟便發布了兩個新HMO物質的批準公告,分別為3-FL和6’-SL,均為微生物來源,具體批準信息詳見下文。
擴展鏈接:
3-巖藻糖基乳糖(微生物來源)
3-Fucosyllactose produced by a derivative strain of Escherichia coli K-12 DH1

2023年10月23日,歐盟委員會發布新條例(EU) 2023/2210,根據歐洲議會和理事會法規(EC) No 2015/2283,批準3-巖藻糖基乳糖(3-Fucosyllactose,來源:大腸桿菌K-12 DH1 衍生菌株)作為新型食品投放市場,本法規自2023年11月12日起正式生效。
申報公司:Glycom A/S(丹麥)
自2023年11月12日起的五年內,僅Glycom A/S有權在歐盟市場銷售3-巖藻糖基乳糖,除非:
- 后續申請人的申報材料符合(EU)2015/2283第26條規定,未參考Glycom A/S納入數據保護的專有科學依據或數據;
- 后續申請人獲得Glycom A/S的授權。
批準使用范圍和用量見下:
3-巖藻糖基乳糖 (微生物來源) | 使用范圍 | |
食品分類 | 最大使用量 | |
嬰兒配方奶粉 | 1.75 g/L(終產品即食狀態下),或以生產商說明為準。 | |
較大嬰兒配方奶粉 | 1.75 g/L(終產品即食狀態下),或以生產商說明為準。 | |
巴氏殺菌和滅菌(包括超高溫滅菌)乳制品 | 2.0 g/L | |
發酵乳制品 | 2.0 g/L (飲料) | |
4.0 g/kg (除飲料外的其他產品) | ||
包括經熱處理的調味發酵乳制品 | 2.0 g/L (飲料) | |
12.0 g/kg (除飲料外的其他產品) | ||
谷物棒 | 25.0 g/kg | |
含乳飲料及類似產品 | 2.0 g/L(終產品即食狀態下),或以生產商說明為準。 | |
12.0 g/kg (除飲料外的其他產品) | ||
飲料(風味飲料,不包括酸堿值低于5的飲料) | 1.25 g/L | |
體重控制用全營養代餐食品 | 2.0 g/L (飲料) | |
25.0 g/kg (除飲料外的其他產品) | ||
特殊醫學用途食品(不包括嬰幼兒食品) | 按特定營養需求適量食用,但在任何情況下,終產品即食狀態下不得超過4.0 g/L 或4.0 g/kg,或以生產商說明為準。 | |
食品補充劑(適用一般人群,不包括嬰幼兒) | 4.0 g/天 | |
標簽要求 | ||
1.含有本品的食品標簽應標注其名稱為“3-巖藻糖基乳糖(3-Fucosyllactose)”; 2.含有本品的食品補充劑標簽應注明:
| ||
2. 6’-唾液酸乳糖鈉鹽(微生物來源)
6’-Sialyllactose sodium salt produced by derivative )strain of Escherichia coli W (ATCC 9637)

2023年10月24日,歐盟委員會發布新條例(EU) 2023/2215,根據歐洲議會和理事會法規(EC) No 2015/2283,批準6’-唾液酸乳糖鈉鹽(6'-Sialyllactose sodium salt , 來源:大腸桿菌W (ATCC 9637)衍生菌株)作為新型食品投放市場,本法規自2023年11月13日起正式生效。
申報公司:協和/Kyowa Hakko Bio Co., Ltd(日本)
自2023年11月13日起的五年內,僅協和有權在歐盟市場銷售6’-唾液酸乳糖鈉鹽(來源:大腸桿菌W (ATCC 9637)衍生菌株),除非:
- 后續申請人的申報材料符合(EU)2015/2283第26條規定,未參考協和納入數據保護的專有科學依據或數據;
- 后續申請人獲得協和的授權。
批準使用范圍和用量見下:
6’-唾液酸乳糖鈉鹽(微生物來源) | 使用范圍 | |
食品分類 | 最大使用量 | |
巴氏殺菌和滅菌(包括超高溫滅菌)乳制品 | 0.5 g/L | |
發酵乳制品 | 0.5 g/L (飲料) | |
2.5 g/kg (除飲料外的其他產品) | ||
包括經熱處理的調味發酵乳制品 | 0.5 g/L (飲料) | |
5.0 g/kg (除飲料外的其他產品) | ||
飲料(風味飲料,不包括酸堿值低于5的飲料) | 0.5 g/L | |
谷物棒 | 5.0 g/kg | |
嬰兒配方奶粉 | 0.4 g/L(終產品即食狀態下),或以生產商說明為準。 | |
較大嬰兒配方奶粉 | 0.3 g/L(終產品即食狀態下),或以生產商說明為準。 | |
加工谷物類嬰幼兒食品 | 0.3 g/L (飲料),終產品即食狀態下,或以生產商說明為準。 | |
2.5 g/kg (除飲料外的其他產品) | ||
含乳飲料及類似產品 | 0.3 g/L (飲料),終產品即食狀態下,或以生產商說明為準。 | |
體重控制用全營養代餐食品 | 1.0 g/L (飲料) | |
10.0 g/kg (除飲料外的其他產品) | ||
特殊醫學用途食品 | 按特定營養需求適量食用 | |
食品補充劑(不包括嬰幼兒) | 1.0 g/天 | |
標簽要求 | ||
| ||
注:文內信息來源于歐盟官方公報 (Official Journal of the European Union)。
相關推薦:
- 母乳低聚糖有最新進展,涉及2’-FL和乳糖-N-新四糖
- 母乳低聚糖(HMOs)中的2'-巖藻糖基乳糖(2'-FL)在中國何時迎來批準的“春天”?
- 非動物成分乳鐵蛋白——TurtleTree精準發酵助力“人造奶”市場
- “半年報”——2023年上半年食品添加劑新品種申報審批情況分析
