自新冠肺炎疫情爆發以來,疫情防控用醫療器械需求量暴漲,其中醫用口罩一直站在疫情防控用品供應的最前線,出現了供應緊張的局面。浙江、廣東、江蘇等多省積極采取應對措施,迅速啟動省級《醫療器械應急審批程序》,以助力生產企業快速合規上市,保障疫情防控物資的供應。
作為具備醫用口罩生產能力,愁于如何申報的企業,面對這次應急審批,我們該如何快速的申報并通過審批?
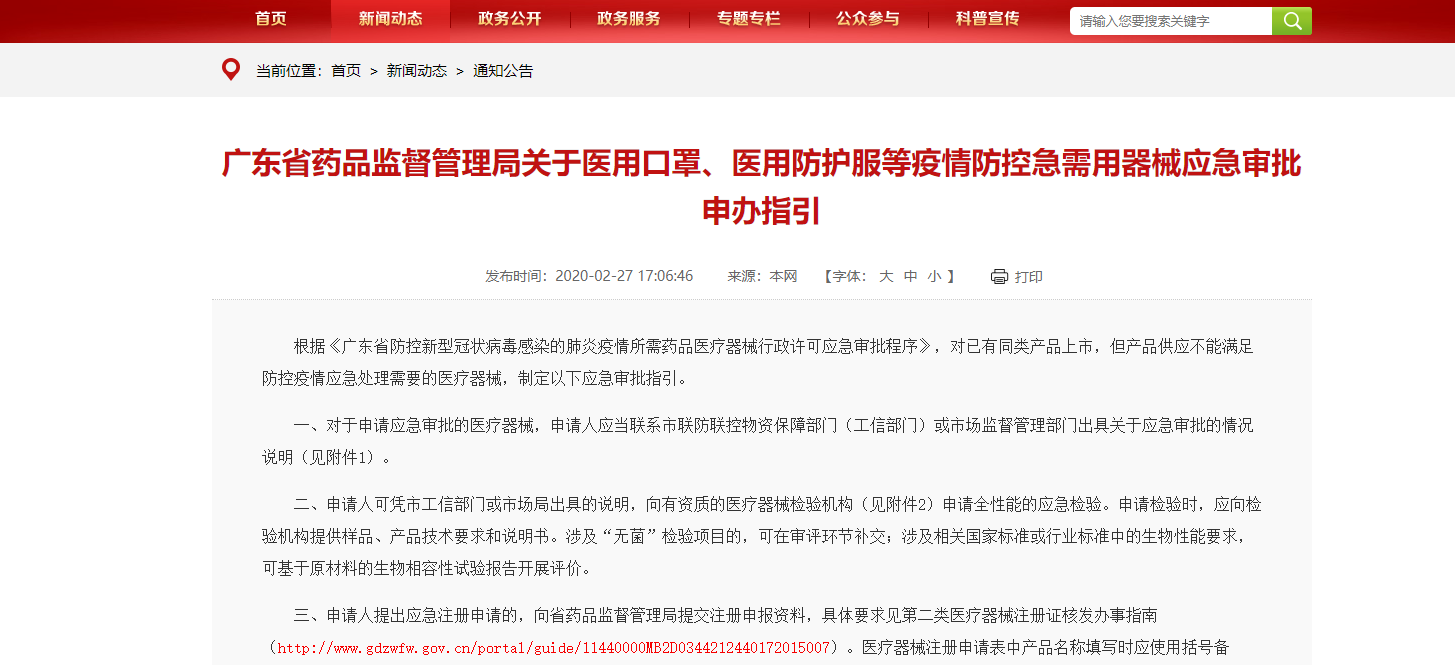
首先,來看一下具體的流程,如圖1浙江省應急審批流程,圖2江蘇省應急審批流程圖,由于各省情況存在差異,可以通過本省藥品監督管理局和醫療器械檢驗研究院的網站發布進行查看。例如:浙江省在藥品監督管理局首頁發布了《關于發布防控新型冠狀病毒感染的肺炎疫情所需醫療器械應急審批程序的公告(2020)》以及在醫療器械檢驗研究院的網站上發布了《應急產品送檢指南》。


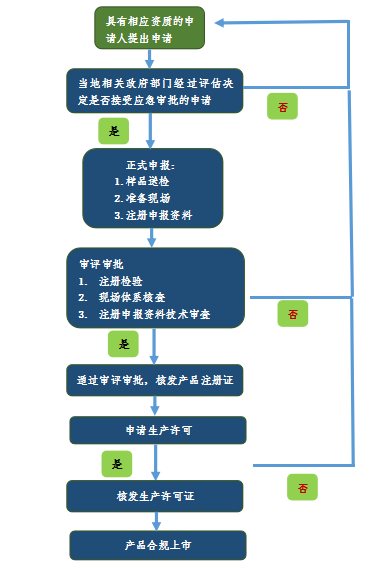
圖1.浙江省應急審批流程圖
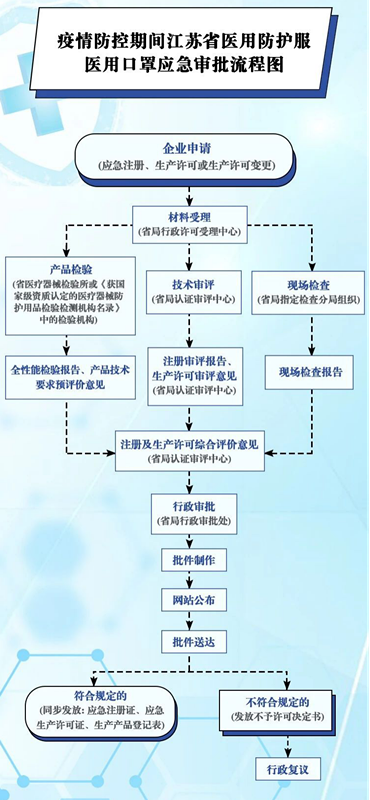
圖2.江蘇省應急審批流程圖(來源于江蘇省藥監局公眾號)
1. 申請應急審批的企業需要具備哪些條件?
本省內具備醫用口罩生產能力的企業,例如:生產無菌醫用口罩應具備不低于30萬級生產環境潔凈度級別,并提供相應的檢測報告。
2. 正式申報和審評審批階段
應急審批并不能豁免注冊檢驗、體系核查和技術審評,仍需要按照流程辦理,但這三項可同步進行,從而壓縮整個注冊周期。以最近在安徽省藥監局申報的一次性使用醫用口罩的應急審批為例,進度如圖3所示,2月26日網上提交電子資料,2月27日通過網上預審和許可受理,在2020年02月29日接受現場體系核查。為了加快進度,先安排樣品送檢進行注冊檢測,在2月24日送檢,檢驗周期在10-20個工作日。縱觀注冊檢驗、技術審查、體系核查的周期,正好在產品檢驗期間完成技術審查和體系核查。

圖3 產品注冊進度
3. 生產許可申請
當獲得產品注冊證后立即提出生產許可的申請,在申報生產許可的時候需要提交產品注冊證和技術要求復印件,在資料準備齊全的情況下,會快速通過審核,拿到生產許可證。
綜合各地區發布的應急審批的通知,醫用口罩注冊的周期表1所示。
注冊檢驗 | 體系核查 | 注冊資料審查 | 行政審批 | 生產許可 | 最短周期 |
以10個工作日估算 | 以3個工作日估算 | 以5個工作日估算 | 以3個工作日估算 | 以5日估算 | 約為15個工作日 |
備注:本表僅供參考,各地區存在差異,請以當地情況為準
