為助力各省醫療器械應急審批舉措,確保醫療器械在疫情情況下的注冊申報符合要求,瑞旭集團特匯總現行國家藥監局及各省市藥監局關于醫用口罩和防護服等醫療器械產品應急審批的最新政策情況。目前為止,以下各省市應急審批通道均未關閉(僅個別省份關閉應急審批通道),且應急審批關閉時間視疫情情況待定。各省市應急審批政策均屬于此次疫情防控期間的臨時應急措施,疫情結束后自行解除。
醫用口罩、防護服等醫療器械應急審批政策匯總如下:
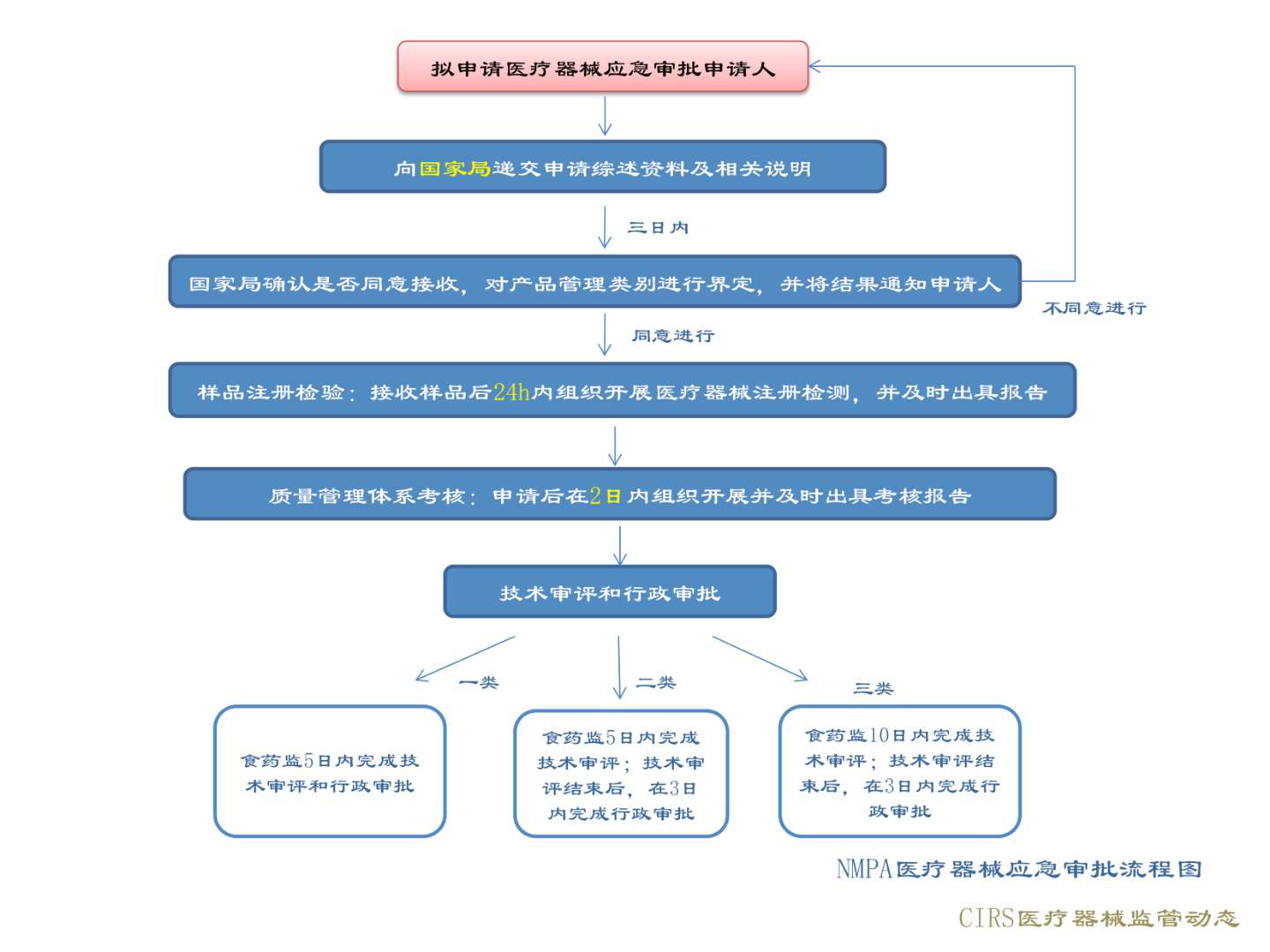
國家藥品監督管理局(NMPA):
《關于印發醫療器械應急審批程序的通知》(國食藥監械﹝2009﹞565號)
《關于加快醫用防護服注冊審批和生產許可的通知》(藥監綜械管函﹝2020﹞71號)
主要應急審批保障措施:
在確保產品安全性和有效性基礎上,加快審評審批;
對于醫用口罩、醫用防護服等醫療器械產品的注冊、生產許可和檢驗檢測等實施特別措施,合并審批流程;
對于轉產生產醫療器械的企業實行應急審批,依法辦理醫療器械注冊證和生產許可證;
對進入醫療器械應急審批程序且與新冠肺炎相關的防控產品,均免征注冊費用。
審批流程:
廣東省
《廣東省防控新型冠狀病毒感染的肺炎疫情所需藥品醫療 器械行政許可應急審批程序》粵藥監辦許〔2020〕48號
《廣東省藥品監督管理局辦公室關于調整一級響應期間對醫用口罩等防控急需用器械實施特殊管理的通知》粵藥監辦許〔2020〕78號
《關于執行疫情防控藥品醫療器械產品注冊“零收費”政策有關事項的通知》粵藥監許業〔2020〕76號
《廣東省藥品監督管理局關于醫用口罩、醫用防護服等疫情防控急需用器械應急審批申辦指引》
應急審批范圍:已有同類產品上市,但產品供應不能滿足防控疫情應急處理需要的醫療器械,如醫用口罩,醫用防護服;
1 | 06-01-11攜帶式X射線機 |
2 | 06-13-01紅外熱像儀 |
3 | 07-01-02電子聽診器 |
4 | 07-03-04體溫測量設備 |
5 | 07-03-05脈搏血氧測量設備 |
6 | 08-04醫用制氧設備 |
7 | 08-05呼吸、麻醉、急救設備輔助裝置 |
8 | 14-02血管內輸液器械 |
9 | 14-13手術室感染控制用品 |
10 | 14-14醫護人員防護用品 |
11 | 22-04免疫分析設備 |
12 | 22-11采樣設備和器具 |
應急審批政策:
3月1日起停止全省疫情防控所需第二類醫療器械應急備案工作,應急審批通道仍然開啟;
應急審批批件僅在防控新冠肺炎疫情期間有效;
對已應急備案或已應急審批的,有意愿繼續生產的,省局按照“標準不降低、程序不減少”的原則,予以優先審評審批,并減免注冊費。
疫情結束后,對于在疫情期間通過應急審批程序獲批批件,申請人可再次申請相同行政許可事項的,其注冊收費標準按零收費執行。
應急審批時限:
二類器械首次注冊,符合應急審批要求的,在2日內組織開展現場檢查、5日內完成技術審評、3日內完成行政審批;
對于納入應急審批的第二類醫療器械許可事項變更申請,3日內完成技術審評、2日內完成行政審批,可接受企業自檢報告并附條件審批。
江蘇省
《省局研究部部署醫用防護服醫用口罩應急備案轉為應急審批事項》
《關于加強新冠肺炎疫情間醫用防護服醫用口罩應急審批和質量監管工作的通知》
應急審批目錄:醫用防護服、醫用口罩、隔離艙等
應急審批保障措施:
免征醫療器械產品注冊費;
停止醫用防護服醫用口罩的應急備案,實施醫用防護服醫用口罩的應急審批;
應急注冊證和生產許可證有效期原則上不超過一年;
應急產品注冊證到期后,再次申請時省局予以優先審批,已提交的資料可以免交;
北京市
《關于促進疫情防控用藥品和醫療器械產品研發及審評審批相關工作的通知》京藥監發〔2020〕26號
應急審批目錄:
醫用口罩、醫用防護服、紅外測溫設備、呼吸麻醉設備配套附件、醫用血氧儀、遠程醫療相關軟件、與病毒檢測配套使用的體外診斷試劑和儀器。
應急審批保障措施要點:
開通綠色通道,早期介入、隨到隨審;
成立應急審批工作專班,建立檢驗、受理、審評、審批聯動機制,將檢驗檢測、注冊核查、審評、審批等環節平行進行,將產品注冊核查和生產許可現場檢查進行合并,保證企業盡快獲得產品注冊證及生產許可證;
上海市
關于做好本市新型冠狀病毒感染的肺炎疫情防控期間醫療器械應急審批工作的通知滬藥監械注〔2020〕32號
應急審批目錄:醫用一次性防護服,醫用外科口罩,醫用防護口罩,醫用隔離面罩。醫用隔離眼罩,一次性使用醫用橡膠檢查手套,一次性使用滅菌橡膠外科手套
應急審批保障措施要點:
簡化申請資料,提前介入并聯辦理;
申請人免于繳納注冊費用;
鼓勵有條件的企業轉產防控應急使用的防護服、口罩;
審批時限:檢測所1日內組織開展注冊檢驗,上海藥監局在受理注冊申請3日內,組織開展技術審評、注冊和生產許可現場體系核查;技術審評結束后,在1日內完成行政審批。
浙江省
關于發布防控新型冠狀病毒感染的肺炎疫情所需醫療器械應急審批程序的公告(2020年 第2號)
應急審批目錄:醫用口罩、醫用防護服、紅外測溫設備等。不在此范圍內,但申請人認為屬防控疫情所需應予應急審批的,也可按本程序申請。
應急審批保障措施要點:
納入應急審批程序的醫療器械產品免征注冊費;
應急審批的注冊證有效期暫定為6個月;
納入醫療器械應急審批的申請人應當立即生產樣品送檢,同時按照注冊法規準備注冊申報資料,申請人向省局提交注冊申報資料時允許容缺受理,暫不提交產品檢驗報告。
審批時限:10日內
山東省:
應急審批目錄:醫用防護服,醫用防護口罩,醫用外科口罩,醫用口罩,呼吸濕化器,傳染病員運送負壓隔離艙,試劑盒
應急審批保障措施要點:
提前介入、容缺受理,加快審評審批;
江西省:
《江西省新型冠狀病毒感染的肺炎疫情防控急需第二類醫療器械注冊應急審評審批工作程序》
《江西省藥品監督管理局關于印發有效應對疫情穩定經濟增長10條政策措施的通知》
《江西省藥品監督管理局對新型冠狀病毒感染肺炎疫情防控用醫療機構制劑應急審評審批的工作程序和措施》贛藥監藥注〔2020〕4號
應急審批目錄:
序號 | 產品名稱 | 符合標準 |
1 | 醫用防護服 | GB19082-2009 |
2 | 醫用防護口罩 | GB19083-2010 |
3 | 醫用外科口罩 | YY0469-2011 |
4 | 一次性使用醫用口罩 | YY/T0969-2013 |
5 | 體溫測量設備 | |
6 | 一次性使用滅菌橡膠外科手套 | GB7543-2006 |
7 | 一次性使用橡膠檢查手套 | GB10213-2006 |
應急審批保障措施要點:
減免藥品醫療器械注冊費;
對于疫情防控期間防護口罩、防護服等企業研發、試產、改進工藝的首次樣品檢驗全部免費;
檢測研究院開通檢驗綠色通道,實施即到即檢,并及時出具檢驗報告;
應急審批期限:
檢測中心24h內開展應急注冊檢驗;審評中心在收到體系核查申請后,2日內組織應急注冊體系核查;在接到注冊申請資料后,應在5日內完成技術審評;技術審評結束后,行政審批部門應當在3日內完成應急行政審批。
安徽省
應急審批目錄:新型冠狀病毒感染的肺炎疫情防控用二類醫療器械
主要應急審批保障措施:
建立綠色通道,省局檢驗、審評、審批部門建立工作機制,專人負責,協同辦理。
陜西省
《陜西省緊急醫用防護用品滅菌規范》《陜西省醫用防護產品應急審批生產風險管控辦法》的通知 陜藥監辦發〔2020〕11號
《陜西省疫情防控所需醫療器械應急審批程序》(試行)陜藥監發〔2020〕13號
應急審批目錄:
陜西省境內生產的防控疫情所需醫療器械,包括醫用口罩、醫用防護服等產品。
應急審批保障措施:
采取產品檢測、技術審評、質量管理體系核查、行政審批同步進行,注冊申請與生產許可同步審批的原則;
隨時做好注冊產品檢測、技術審評、現場核查
設專門電話,負責相關醫療器械注冊的咨詢服務、協調和技術指導
應急審批時限:10日內
云南省
《云南省藥品監督管理局關于疫情防控用醫療器械先生產后審批有關事項的通知》
應急審批目錄:呼吸麻醉設備、紅外測溫設備、醫用防護口罩、醫用外科口罩、一次性使用醫用口罩、無菌隔離衣、醫用一次性防護服、與病毒檢測相關的第二類體外診斷試劑與儀器等。
應急審批措施:
統一指揮、提前介入、快速高效、科學審批;
部分資料可在注冊審批完成半年內補交。
應急審批時限:24h內開展注冊檢驗,5個工作日內完成技術審評,同步開展體系核查和現場檢查,1個工作日內完成行政審批。
甘肅省
《甘肅省藥品監督管理局關于對新型冠狀病毒感染的肺炎疫情防控藥械實施應急審批管理的公告》2020年第8號
應急審批目錄:醫用防護用品、呼吸設備、消毒器械、防治藥品、檢測試劑等
應急審批措施:
提前介入、隨報隨審、科學審批
允許醫療器械經營許可(備案)范圍中無疫情防控急需器械的企業,遵循先行購進、先行保障市場供應的原則,購進和銷售相關產品
允許省內取得二類防護類醫療器械注冊證的企業(持有人)委托具有相應生產能力的生產企業進行產品生產
黑龍江省
《黑龍江省藥品監督管理局關于對疫情防控急需藥品和醫療器械應急審評審批相關工作的通知》(黑藥監藥注〔2020〕16號)
應急審批目錄:醫用口罩、醫用防護服等II類醫療器械產品及疫情防控急需而未在中國注冊的進口醫療器械產品。
應急審批措施:
對于疫情所急需的醫用口罩、醫用防護服等II類醫療器械產品及疫情防控急需而未在中國注冊的進口醫療器械產品,給予快速審評審批或出具進口證明。
即刻受理、簡化申報材料、啟動受理、審評、檢驗、審批聯動機制、批準證明文件在疫情結束后自動失效。
河北省
河北省藥品監督管理局關于重大突發公共衛生事件一級響應期間對疫情防控急需醫療器械實施特殊管理的通知
《河北省藥品監督管理局關于發布河北省第二類醫療器械應急審批產品目錄的通知》 冀藥監械注函〔2020〕69號
《河北省藥品監督管理局關于新冠肺炎防控期間行政審批事項辦理有關事宜的公告》2020年第16號
醫用防護服、醫用普通口罩、醫用外科口罩、醫用防護口罩、紅外測溫設備、呼吸麻醉設備配套附件、醫用血氧儀、酒精棉片、一次性使用滅菌橡膠外科手套、一次性使用無菌醫用橡膠檢查手套、數字化移動式X射線機、與病毒檢測相關的第二類體外診斷試劑和儀器。
應急審批保障措施:
減免注冊費;
統一指揮、早期介入、隨到隨審、行政許可現場檢查與注冊質量體系現場核查同步進行、科學審批,部分事項先批后查;
延長許可時限。疫情防控期間,除醫療器械生產許可延續因系統限制不可推遲外,醫療器械及再注冊證書到期后自動延續有效,待重大突發公共衛生事件一級響應解除后再辦理相關手續。
允許未取得醫療器械生產許可證的出口企業接受委托生產。
河南省
《河南省藥品監督管理局關于促進醫用口罩醫用防護服產能提升的意見》豫藥監械注〔2020〕19號
應急審批目錄:醫用口罩、防護服等防控急需的醫療器械
應急審批保障措施:
開通應急審批通道,增加產品型號規格;
允許省內使用符合歐美日韓標準的醫用口罩等一、二類疫情防控醫療器械產品;
允許使用簡易包裝,但初包裝應符合要求;
從境外緊急進口符合美國、歐盟、日本和韓國相關標準的醫療器械按照相關要求快速辦理。
應急審批期限:對具備醫用口罩、醫用防護服生產條件的新開辦企業,可以采取先生產、再走程序、補手續的應急辦法。企業提出申請后,24小時內組織安排現場核查、技術審評。經審查符合要求后,24小時內核發相關批件。生產現場存在問題,不影響產品質量安全的,可邊生產邊整改。
吉林省
應急審批目錄:疫情防控急需醫療器械
應急審批保障措施:
開通綠色審批通道,對相關醫療器械實行即受理即辦制度,并全程跟蹤服務。
廣西省
應急審批目錄:醫用口罩、防護服、手持式測溫儀等醫療器械
應急審批措施:
無紙化網上即時受理、容缺受理、附條件審批、免收注冊費和檢驗檢測費;
應急審批期限:
符合應急審批要求的醫療器械,2日內組織開展現場檢查,2日內完成技術審評,1日內完成注冊許可,次日完成生產許可;
對于廣西無同類產品的醫療器械應急審批申請,2日內組織開展現場檢查,1日內完成技術審評和注冊許可,次日完成生產許可;
對于納入應急審批的第二類醫療器械許可事項變更申請和延續注冊申請,2日內組織開展現場檢查,1日內完成技術審評,1日內完成注冊許可和生產許可。
貴州省:
《省藥品監管局關于對新型冠狀病毒感染的肺炎疫情防控用醫療器械實施應急審批的公告》
應急審批目錄:疫情防控急需醫療器械
應急審批保障措施:
對應急審評審批的疫情防控急需醫療器械產品免收注冊費。
省藥品監管局可指派專人實施全程指導,在不降低審評審批標準的情況下,幫助企業最大限度提高申報速度。待審查同意后,給予“疫情防控急需醫療器械準予臨時生產批復”;
允許使用簡易包裝;
福建省:
應急審批目錄:防護醫療器械產品(醫用口罩、醫用外科口罩、醫用防護口罩、醫用防護服)
應急審批措施:
簡化申報程序;
頒發有效期3個月的臨時醫療器械注冊證和生產許可證,認可企業自檢報告;
遼寧省
省藥監局開展24小時不間斷應急審批服務兩日內完成我省2家口罩生產企業全部審批手續
應急審批目錄:口罩、隔離衣、額溫計應急審批保障措施:
按照特事特辦、24小時不間斷服務的原則
公布了各市場監督管理局負責相關工作的人員及聯系方式
湖南省
應急審批目錄:無創呼吸機、醫用防護服,醫用口罩、手套、紅外線體溫計、高流量呼吸濕化治療儀、正壓通氣面罩、一次性使用醫用墊單
應急審批措施:
發布措施,鼓勵企業轉型轉產建立制度,指導企業生產轉化。
山西省
山西省藥品監督管理局關于對防控疫情用醫療器械實行應急審批的通告(2020年第8號)
山西省新冠肺炎疫情所需藥品醫療器械應急審批程序(2020年第11號)
山西省藥品監督管理局新冠肺炎疫情期間支持復工復產的通告(2020年 第13號)
應急審批目錄:生產醫用口罩、醫用防護服、呼吸機等對防控疫情所需醫療器械
應急審批措施:
統一指揮、早期介入、隨到隨審、科學審批;
成立應急審批技術指導組;
注冊零收費;
設專門電話,負責咨詢協調;
應急審批時限:應急審批檢測機構在接收樣品后24h內組織檢測, 2日內組織開展現場檢查,5日內完成技術審評,3日內完成行政審批。
瑞旭集團提醒各醫療器械企業,以上各地醫療器械應急政策情況是基本當前政策整理,應急審批政策隨著疫情防控的情況會隨時調整,請各醫療器械企業根據當地政策,并與當地監管部門溝通后及時調整醫療器械注冊申報策略。
