1. 注冊申報資料哪些文件需要同時提供電子稿?
| 序號 | 文件名 | 格式 |
| 1 | 申請表 | 醫療器械申報電子軟件生成的格式,醫療器械注冊管理系統待啟用 |
| 2 | 產品技術要求 | Word文檔 |
| 3 | 僅包含技術要求性能指標部分的文件 | Word文檔 |
| 4 | 綜述資料 | Word文檔 |
| 5 | 研究資料概述 | Word文檔 |
2. 若申請注冊產品不涉及某些項目,如軟件研究,請問如何編排注冊資料?
若產品不涉及某些項目,如軟件研究,那么申報資料中“5.7軟件研究”仍然需要“5.7軟件研究”,內容主要要描述產品不涉及軟件,不需要進行軟件研究。
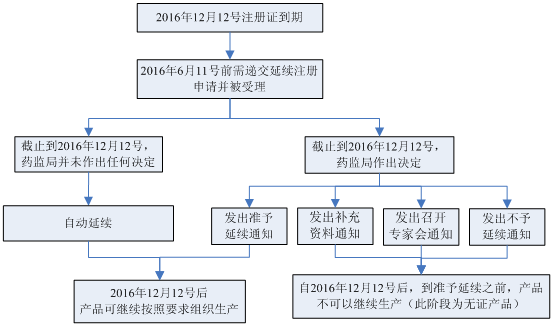
3. 對于醫療器械注冊證快到期了,怎么延續?我們給大家分享過經驗,那延續注冊期間,注冊證到期后,還能繼續生產嗎?
以2016年12月12號到期的第II類或第III類醫療器械注冊證為例:
4.進口醫療器械受理環節注意事項
| 申報資料 一級標題 | 申報資料 二級標題 | 受理環節審查重點 |
| 1.申請表 | / | 申請表中信息與證明性文件中信息的一致性,如申請人住所、代理人住所、生產地址等信息 |
| 2.證明性文件 | 進口產品:境外上市銷售的證明文件、企業資格證明文件。代理人的委托書、代理人承諾書及營業執照副本復印件或者機構登記證明復印件 | 證件或文件的有效期、信息的一致性等 |
| 3.醫療器械安全有效基本要求清單 | 表格填寫是否規范 | |
| 4.綜述資料 | 4.1概述 4.2產品描述 4.3型號規格 4.4包裝說明 4.5適用范圍和禁忌癥 4.6參考的同類產品或前代產品的情況(如有) 4.7其他需說明的內容 | 若為進口產品,預注冊產品是否在型號規格、產品描述、適用范圍和禁忌癥等方面均符合進口上市證明文件中的相關描述(不可超出進口上市證明文件中的規定) |
| 5.研究資料 | 5.1產品性能研究 5.2生物相容性評價研究 5.3生物安全性研究 5.4滅菌和消毒工藝研究 5.5有效期和包裝研究 5.6動物研究 5.7軟件研究 5.8其他 | / |
| 6.生產制造信息 | 6.1 無源產品/有源產品生產過程信息描述 6.2生產場地 | / |
| 7.臨床評價資料 | / | |
| 8.產品風險分析資料 | / | |
| 9.產品技術要求 | 需提供外文1份(生產企業簽章并公證);中文2份(代理人蓋章)且需寫2份一致性聲明 | |
| 10.產品注冊檢驗報告 | 10.1注冊檢驗報告 10.2預評價意見 | 檢測機構是否有資質 |
| 11.說明書和標簽樣稿 | 11.1說明書 11.2最小銷售單元的標簽樣稿 | 原文說明書和標簽是否公證 中文說明書和標簽由代理人簽章即可 |
| 12.符合性聲明 | 12.1聲明書:符合相關法規、符合分類要求、符合國標行標。 12.2 真實性聲明 | 聲明書:生產企業出具 真實性聲明: 1.生產企業出具 2.代理人出具 |
| 注: 1.但凡生產企業研發、生產等環節涉及的資料,均需要生產企業出具 2.生產企業簽章的文件或第三方出具的文件均需公證 | ||
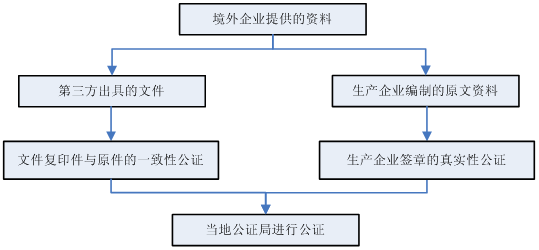
5. 進口產品資料公證?
5.1 進口生產企業出具的資料應該如何進行公證?
5.2 哪些資料需要公證?
| 一致性公證 | 真實性公證 |
| 1. 若在境外國作為醫療器械 (1) 進口醫療器械主管部門出具產品符合上市要求的證書,如FDA證書、CE證書 (2) 生產許可證或制造業許可證 (3) 商業登記證書 2. 若在境外國不作為醫療器械監管 (1) 提供相關證明文件 (2) 產品上市銷售的證明文件 (3) 生產許可證或制造業許可證 (4) 商業登記證書 | 1.代理人委托書 2.醫療器械安全有效基本要求清單 3.綜述資料 4.生產制造信息 5.產品風險分析資料 6.產品技術要求(外文版) 7.說明書和標簽樣稿(原文版) 8.生產企業出具的聲明書 9.生產企業出具的真實性聲明 |
| 備注: 若以下資料中包括第三方出具的資料(如檢測報告復印件)和生產企業編制的資料,則需要分別進行相應的一致性公證和真實性公證: 1.研究資料 2.臨床評價資料 | |
5.3 每份資料均需單獨公證嗎?
CFDA認可合并在一起后進行公證,故不需要每份資料均單獨公證。合并公證后的公證件可以作為進口醫療器械注冊申請表中所附資料“15、申請人所在地公證機構出具的原文/英文資料公證件”的資料。
6. 注冊檢測注意事項有哪些?
6.1 首先與有資質的檢測所溝通確定:樣品量、送檢資料、檢測周期、檢測費用、預付款等信息。
6.2 準備樣品、樣品貼標簽,編寫送檢資料,送檢資料一般包括以下內容:
| 通用要求 | 無源產品 | 有源產品 |
| 1.產品技術要求 | 若產品涉及有效期,生產企業需提供 1. 效期驗證報告 2. 效期驗證報告認可申請 | 1. 關鍵元器件的3C認證證書等 2. 自行下載檢測所要求其他資料如關鍵件清單、EMC送檢資料 |
| 2.產品說明書 | ||
| 3.注冊檢測合同 | ||
| 4.委托檢測合同—針對生物學評價試驗 | ||
| 5.聲明書—送檢資料和送檢樣品的真實性和一致性進行聲明 | ||
| 注:上述所有資料均需生產企業或代理人簽章。 | ||
6.3 對于有源產品,電氣安全和電磁兼容(EMC)可以同步進行嗎?
一般電氣安全檢測的前提是電磁兼容檢測合格,若企業想加快檢測進度,電氣安全和電磁兼容檢測可以同步進行,但是若涉及電磁兼容需要整改,電氣安全檢測需重新檢測,所以會面臨電氣安全已檢項目費用不予退回的風險。
