體外診斷試劑注冊證申請、生產許可證申請、經營許可證申請均會涉及有關藥監局對企業進行現場核查。根據相關法規依據,瑞旭技術特總結注冊、生產和經營環節現場核查的重點項目。
法規依據:| 序號 | 注冊環節、生產環節 | 經營環節 |
| 1 | 醫療器械生產質量管理規范及醫療器械生產質量管理規范附錄體外診斷試劑 | 醫療器械經營質量管理規范 |
| 2 | 醫療器械生產企業分類分級監督管理規定 | 醫療器械經營企業分類分級監督管理規定 |
| 3 | 醫療器械生產質量管理規范體外診斷試劑現場檢查指導原則 | 醫療器械經營環節重點監管目錄及現場檢查重點內容 |
現場核查發生的時間和條件
| 序號 | 項目 | 注冊環節(以第三類注冊為例) | 生產環節 | 經營環節 |
| 1 | 現場核查條件 | 1.技術審評(CFDA 或省級FDA)收到注冊申請資料; 2.省級FDA收到申請人的體系核查資料 | 省級FDA接收生產許可資料并受理 | 市級FDA接收經營許可資料并受理 |
| 2 | 現場核查時間 | 省級FDA接到通知后30個工作日內完成 | 受理后,一般市級FDA在30個工作日內完成或備案之日起3個月內 | 受理后,一般縣級、區級FDA在30個工作日內完成或備案之日起3個月內 |
| 3 | 涉及現場核查的具體情形 | 技術審評過程中 | 1.首次開辦; 2.許可事項變更; 3.生產許可證延續申請; 4.連續停產一年以上且無同類產品在產的,重新生產時; 5.生產備案后; 6.其他常規檢查時核查 | 1.首次開辦; 2.許可事項變更; 3.經營許可證延續申請; 4.第三類醫療器械經營企業自行停業一年以上,重新經營時; 5.經營備案后; 6.其他常規檢查時核查 |
以境內第三類醫療器械注冊為例,注冊體系核查大致流程如下:
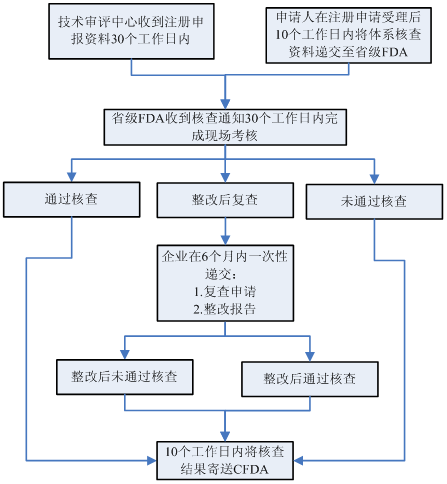
注冊環節和生產環節主要針對與產品研制、生產有關的質量管理體系進行核查。詳細檢查項目參見《醫療器械生產質量管理規范體外診斷試劑現場檢查指導原則》。注冊環節質量體系核查重點針對注冊檢測樣品和臨床試驗樣品的真實性核查(樣品生產的原材料采購、過程檢驗、出廠檢驗等記錄,樣品批號與生產記錄批號的一致性,留樣情況);生產許可環節的質量體系核查重點針對各環節的可追溯性記錄和驗證性文件。
可追溯性主要圍繞設計和開發過程實施策劃和控制的相關記錄。一般主要保證以下環節的可追溯性記錄,同時核查各項記錄相關制度的符合性和完整性。
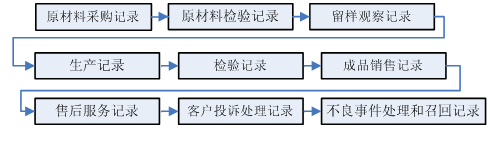
驗證性文件一般主要針對主要生產工藝及反應體系的研究驗證、產品性能研究驗證、穩定性研究驗證等。
經營環節現場檢查重點內容主要依據個地方市局發布的《醫療器械經營企業現場檢查驗收標準》并結合《醫療器械經營環節重點監管目錄及現場檢查重點內容》的要求進行。重點檢查主要圍繞以下幾方面:
| 重點檢查項目 | 詳細內容 |
| 合法資質 | 1.企業營業執照、經營產品的注冊證、銷售人員的授權書 2.供貨者的醫療器械生產(經營)許可證、營業執照 |
| 倉儲管理 | 檢查倉儲管理 1.倉庫設施設備及維護記錄; 2.溫度日常監控記錄; 3.產品存儲狀態是否與說明書要求一致性; 4.產品包裝有否開封或破損; 5.效期預警記錄。 |
| 質量追溯 | 1.計算機信息管理系統能否保證經營的產品可追溯(第三類產品); 2.供貨者隨貨同行單; 3.進貨驗收記錄; 4.出庫復核查驗記錄; 5.銷售記錄; 6.退貨產品或不合格品的處置記錄; 7.說明書和標簽的內容合規性。 |
| 冷鏈運輸 | 1.設施設備是否符合醫療器械儲運過程中對溫度控制的要求; 2.運輸方式及運輸過程的溫度記錄等是否完整并符合規定要求; 3.計量器具使用和檢定記錄。 |
