醫療器械在研發、注冊檢測、臨床試驗、注冊申請、取得證書后上市銷售等環節,不可避免的會面臨相關強制性標準更新的情況,鑒于標準發布后,會有一到兩年的緩沖期才正式實施,因此在強制性標準發布后到實施前的過渡期,很多企業會糾結于如何應對。
下圖為首次注冊申請前、申請過程中、注冊證取得后、許可事項變更(若涉及)、延續注冊申請等不同時間點,強制性標準變更發布時,瑞旭技術建議企業選擇的對策:
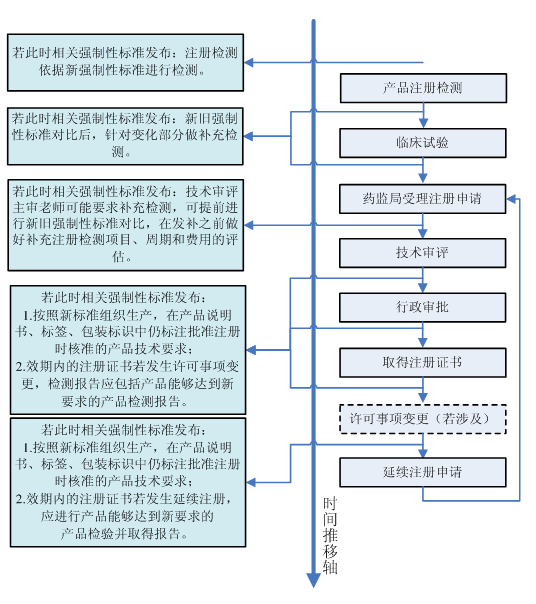
強制性標準變更的形式主要有哪些? 針對不同形式的強制性標準變化,企業具體對策是什么呢?
| 強制性標準 變更形式 | 企業具體應對措施 | 備注 |
| 增加了新項目 | 需評估檢測費用及檢測周期,及時針對新增部分或變化部分進行檢測 | 延續注冊申請須在注冊證到期6個月前提交申請,因此企業應未雨綢繆,針對強制性標準已經實施的情況,相關企業應保證在注冊證到效期6個月前取得變化部分的檢測報告,以免延誤延續注冊申請時機 |
| 原有項目變化(檢測方法或檢測結果參考值),企業原有檢測結果可能不符合新要求 | ||
| 原有項目變化(檢測方法或檢測結果參考值),企業原有檢測結果符合新要求 | 許可事項變更注冊或延續注冊不需要開展符合新標準的注冊檢測。 | 對于許可事項變更注冊,可僅針對變化的許可事項進行相應檢測,不考慮新的強制性標準的要求 |
| 刪除了某些項目 |
瑞旭建議:最好的做法是即使注冊證剛取得不久,若相關強制性標準發布且變化形式涉及“增加新項目、“企業原有檢測結果可能不符合新要求”,企業也應該主動針對變化項目進行注冊檢測,這樣就省掉了變更注冊或延續注冊時的注冊檢測工作量。
