2015年6月8日,國家食品藥品監督管理總局發布“境內第三類醫療器械注冊質量管理體系核查工作程序(暫行)”(食藥監械管【2015】63號),該通知明確了境內第三類醫療器械注冊過程中的體系核查要求,規范了核查程序,并為境內第二類醫療器械注冊體系核查提供了法規依據。
依據該通知要求,企業應在提交注冊之前建立醫療器械生產質量管理體系并在該體系下生產注冊樣品及完成生產工藝驗證工作。- 注冊質量管理體系核查范圍
- 國產第三類醫療器械注冊
- 國產第二類醫療器械注冊
- 進口第二類、第三類醫療器械(注冊體系核查辦法另行制定)
- 核查機構
- 國家食品藥品監督管理總局技術審評機構
- 企業所在地省、自治區或直轄市食品藥品監督管理部門
- 核查依據
- 核查內容
- 核查程序
| 核查程序 | 工作內容 | 周期 (工作日) |
 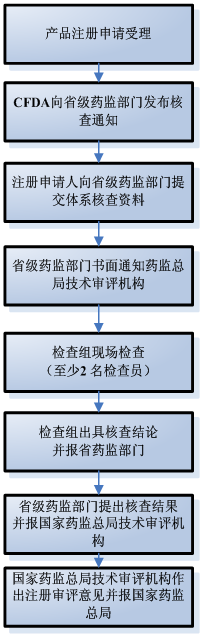 | 國家食品藥品監督管理總局行政服務中心受理醫療器械產品注冊申請 | 5 |
| 藥監總局技術審評機構自收到醫療器械注冊申請資料起30個工作日內,通知相應省、自治區、直轄市食品藥品監督管理部門開展注冊質量管理體系核查。 | 30 | |
| 注冊申請人應當在注冊申請受理后10個工作日內向省、自治區、直轄市食品藥品監督管理部門提交體系核查資料 | 10 | |
| 省、自治區、直轄市食品藥品監督管理部門在開展現場檢查5個工作日前書面通知總局技術審評機構 | 提前5日 | |
| 檢查制定現場檢查方案,組織召開現場檢查并提出檢查結論。 | 1-3 | |
| 檢查組將建議核查結果報省藥監部門,建議結論分為“通過檢查”、“整改后復查”、“未通過檢查”三種情況 | 30 | |
| 省藥監部門對檢查組提交的現場檢查資料進行審核,提出核查結論,核查結論為“通過核查”、“整改后復查”、“未通過核查”三種情況,10日并報總局技術審評機構。 | ||
| 總技術審評中心依據體系核查結果,作為醫療器械注冊技術審評結果的判斷依據,未通過核查的,技術審評中心提出不予注冊的審評意見,食品藥品監督管理部門作出不予注冊的決定。 |
- 核查資料要求
- 注冊申請人基本情況表
- 注冊申請人組織機構圖
- 企業總平面布置圖、生產區域分布圖
- 如生產過程有凈化要求的應提供有資質的檢測機構出具的環境檢測報告(附平面布局圖)復印件
- 產品生產工藝流程圖,應標明主要控制點與項目及主要原材料、采購件的來源及質量控制方法
- 主要生產設備和檢驗設備(包括進貨檢驗、過程檢驗、出廠的最終檢驗相關設備;如需凈化生產的,還應提供環境監測設備)目錄
- 企業質量管理體系自查報告
- 擬核查產品與既往已通過核查產品在生產條件、生產工藝等方面的對比說明(如適用)
- 注冊申報資料復印件:
- 醫療器械(不包括體外診斷試劑):研究資料、產品技術要求、注冊檢驗報告、臨床試驗報告(如有)、醫療器械安全有效基本要求清單
- 體外診斷試劑:主要生產工藝及反應體系的研究資料(第三類體外診斷試劑)、產品技術要求、注冊檢驗報告、臨床試驗報告(如有)
