疫情期間為保障應急醫療物質供應,國家及省級藥監局于2020年1月底先后啟動醫療器械應急審批程序,應急審批醫療器械包括口罩、隔離衣、醫用手套、紅外體溫計、醫用防護服等醫用防護類醫療器械。那么應急審批流程是否會比常規審批簡化一些呢?到底需要提交哪些資料呢?本文整理了應急審批申報與常規注冊申報在流程和資料要求兩個方面的區別,希望能給企業提供一些幫助。
1.申報審批流程的區別
各省份針對符合疫情防控所需的第二類醫療器械的應急審批申請,均相應的開通了綠色通道,提前介入指導,加快審評審批。與常規注冊流程相比,應急審批的注冊流程并沒有減少,而是采取了一系列措施有效壓縮了注冊時長。如將審評審批各環節由“串聯”改為“并聯”,將注冊檢驗、注冊核查、審評、審批等環節平行進行,產品注冊核查和生產許可現場檢查合并開展,從而確保企業盡快取得注冊證及生產許可證。
以浙江省為例,應急審批流程圖如下。
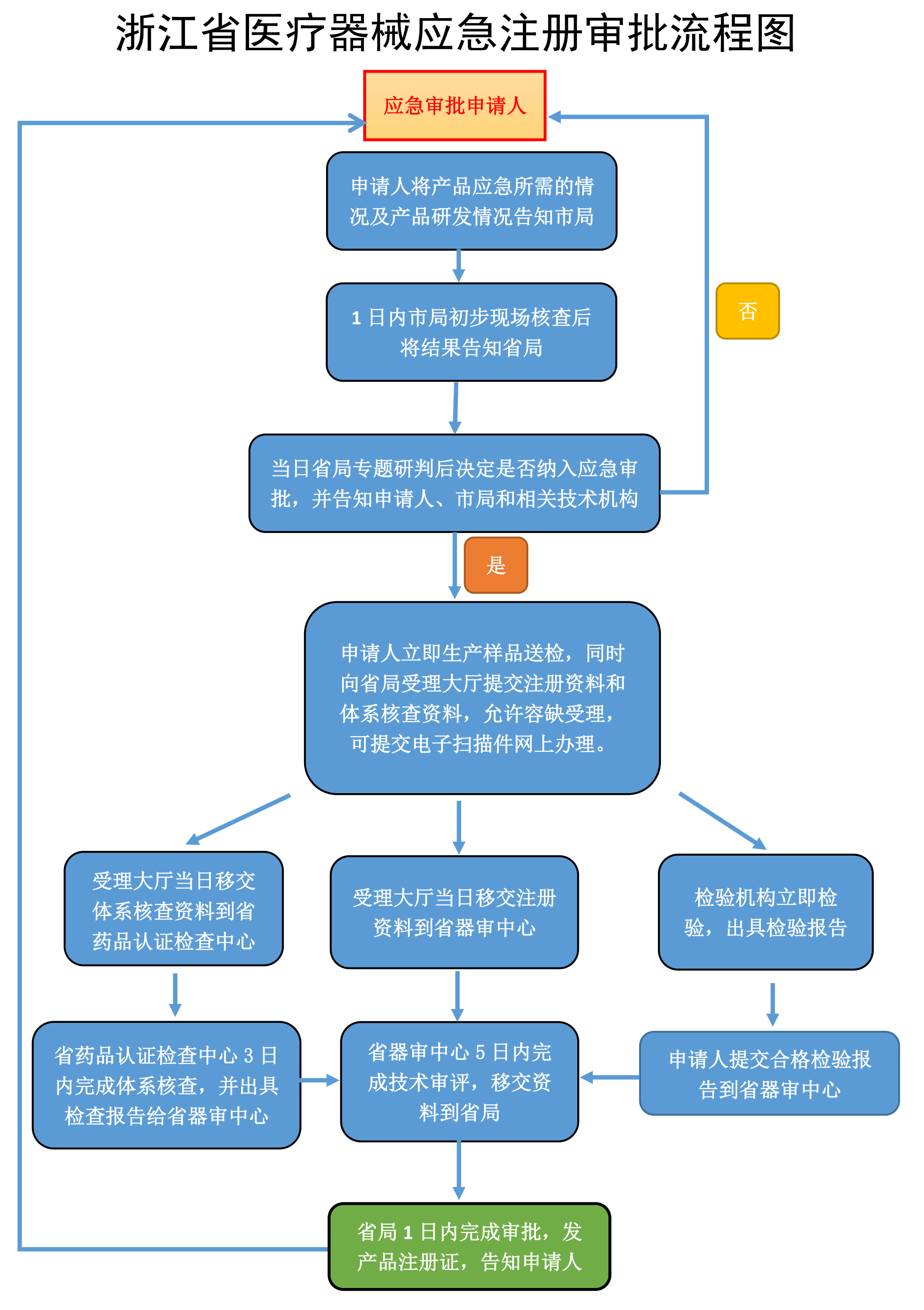
2.申報資料的區別
在應急審批注冊申報資料方面,各省份均采取了容缺受理,一般情況下“醫療器械安全有效基本要求清單”“臨床評價資料”“產品風險分析資料”這三份資料可以不用提交,其余資料因省份不同而有所差異。下面列舉了常規申報資料及部分省份的應急審批資料。
常規注冊申報資料 | 應急申報資料 | |||
一級標題 | 申報資料二級標題 | 一級標題 | 申報資料二級標題 | |
1.申請表 |
| 1.申請表 |
| |
2.證明性文件 |
| 2.證明性文件 |
| |
3.醫療器械安全有效基本要求清單 |
| 醫療器械安全有效基本要求清單 | 選報 | |
4.綜述資料 | 4.1概述 | 3.綜述資料 | 3.1概述 | |
5.研究資料 | 5.1產品性能研究 | 4.研究資料 | 4.1產品性能研究 | |
6.生產制造信息 | 6.1 無源產品/有源產品生產過程信息描述 | 5.生產制造信息 | 5.1生產過程信息描述 | |
7.臨床評價資料 |
| 臨床評價資料 | 選報 | |
8.產品風險分析資料 |
| 產品風險分析資料 | 選報 | |
9.產品技術要求 |
| 6.產品技術要求 |
| |
10.產品注冊檢驗報告 | 10.1注冊檢驗報告 | 7.產品注冊檢驗報告 | 7.1注冊檢驗報告 | |
11.說明書和標簽樣稿 | 11.1說明書 | 8.說明書和標簽樣稿 | 8.1說明書 | |
|
| 9.注冊質量管理體系核查申請表 | 江蘇省要求 | |
12.符合性聲明 |
| 10.符合性聲明 |
| |
以上申報資料是參考部分省份申報資料要求及瑞旭集團注冊申報經驗整理,具體各省醫療器械注冊申報過程資料要求會有些差異,請企業在申報過程中結合當地申報要求準備注冊申報資料。
