由于應急審批的特殊性,通過應急審批獲批的醫療器械注冊證有效期較短,有效期通常是3個月、6個月或1年,注冊證到期后自動失效,部分省份要求重新提交注冊申報,那么注冊證到期后,已經具備醫療器械生產體系的企業該如何正式邁入醫療器械行業,獲得一張真正的“5年有效期注冊證”?
表1整理了常規二類醫療器械注冊需要的資料和注意事項,以備注的形式列明了已獲應急審批注冊證企業需要提前準備及注意的事項,供企業參考。
表1 無源產品應急審批-常規注冊資料銜接
申報資料一級標題 | 申報資料二級標題 | 備注(應急審批資料對比) |
1.申請表 | 與應急審批差別不大 | |
2.證明性文件 | / | |
3. 醫療器械安全有效基本要求清單 | 一一對應各支持材料,確保醫療器械符合安全有效要求 | |
4.綜述資料 | 4.1概述 4.2產品描述 4.3型號規格 4.4包裝說明 4.5適用范圍和禁忌癥 4.6參考的同類產品或前代產品的情況(如有) 4.7其他需說明的內容 | 一般在應急申報中已提供,若后續有更改情況,可根據具體情況進行調整 |
5.研究資料 | 5.1產品性能研究 | 產品性能研究一般按照標準進行制定,若出現與標準不適用或不同項目,需要說明理由并提供企業自定義指標的研究資料 |
5.2生物相容性評價研究 | 需要提前準備。以口罩為例,需要進行基礎三項生物相容性評價(細胞毒性、皮膚刺激、遲發型超敏反應),檢測周期在60個工作日左右。企業可根據產品是否與人體接觸、接觸方式、接觸時間判斷生物相容性評價內容。 | |
5.3生物安全性研究 | 一般應急產品不存在動物來源的材料,此項不適用 | |
5.4滅菌和消毒工藝研究 | 需要提前準備。滅菌型產品需要提供滅菌工藝驗證報告。若產品需要消毒,則提供消毒工藝驗證報告。 | |
5.5有效期和包裝研究 | 需要提前準備。根據產品有效期制定加速老化試驗方案,獲得產品有效期驗證報告。通過跌落試驗、碰撞試驗、運輸試驗等對產品進行包裝研究,證明包裝的適宜性。 | |
5.6動物研究 | 不適用 | |
5.7軟件研究 | 含有軟件的有源設備需要提供軟件描述文檔、涉及到數據交換還需要提供網絡安全描述文檔。 | |
5.8其他 | 不適用 | |
6. 生產制造信息 | 6.1 無源產品生產過程信息描述 | 進行產品生產流程的描述,說明關鍵工藝、特殊工藝的控制點,列明產品生產、檢測需要使用的設備。 |
6.2生產場地 | 生產場地的平面圖 | |
7.臨床評價資料 | 對比同類產品在工作原理、結構組成、性能指標、滅菌方式、性能指標、使用方法等方面的區別。 | |
8.產品風險分析資料 | 需要提前準備。產品風險分析貫穿整個生命周期,企業可根據YY/T 0316—2016進行風險評估分析,形成風險管理計劃和風險管理報告 | |
9.產品技術要求 | 參考標準進行制定,產品送檢時需要提供。 | |
10.產品注冊檢驗報告 | 10.1注冊檢驗報告 10.2預評價意見 | 注冊申報時需要提供。 |
11.說明書和標簽樣稿 | 11.1說明書 11.2最小銷售單元的標簽樣稿 | 在應急申報中已提供,刪除“僅供防控疫情應急使用”字樣,其他與應急審批無差異。 |
12.符合性聲明 | 提供產品符合《醫療器械注冊管理辦法》和相關法規、標準要求的聲明。 |
企業在經歷應急審批后對醫療器械研發、生產、注冊、體系均有了一定了解,重新進行醫療器械注冊申報計劃可提前布局,早做準備,完成“應急審批注冊證”與常規“5年有效期注冊證”的無縫鏈接。圖1為常規醫療器械注冊審批申報流程。
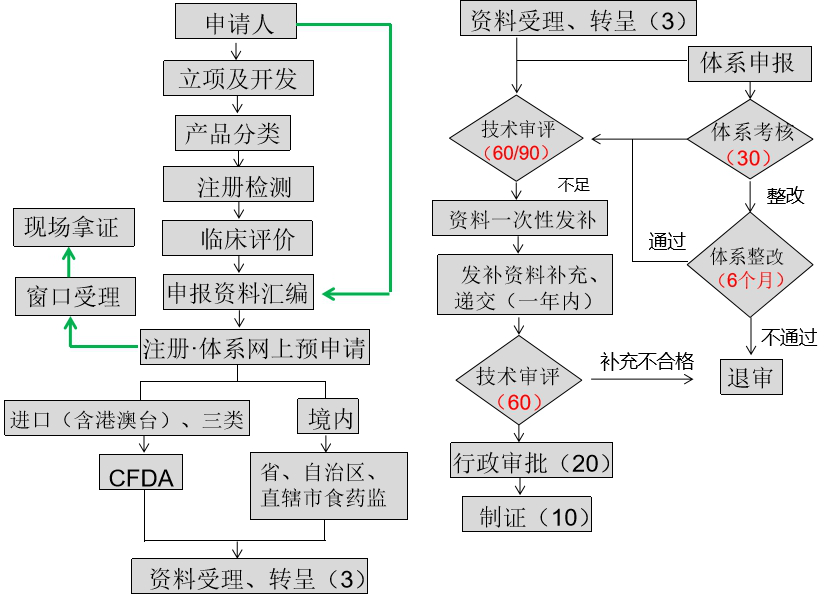
圖1常規醫療器械注冊(備案)流程
注:一類產品備案,資料齊全可現場拿證
