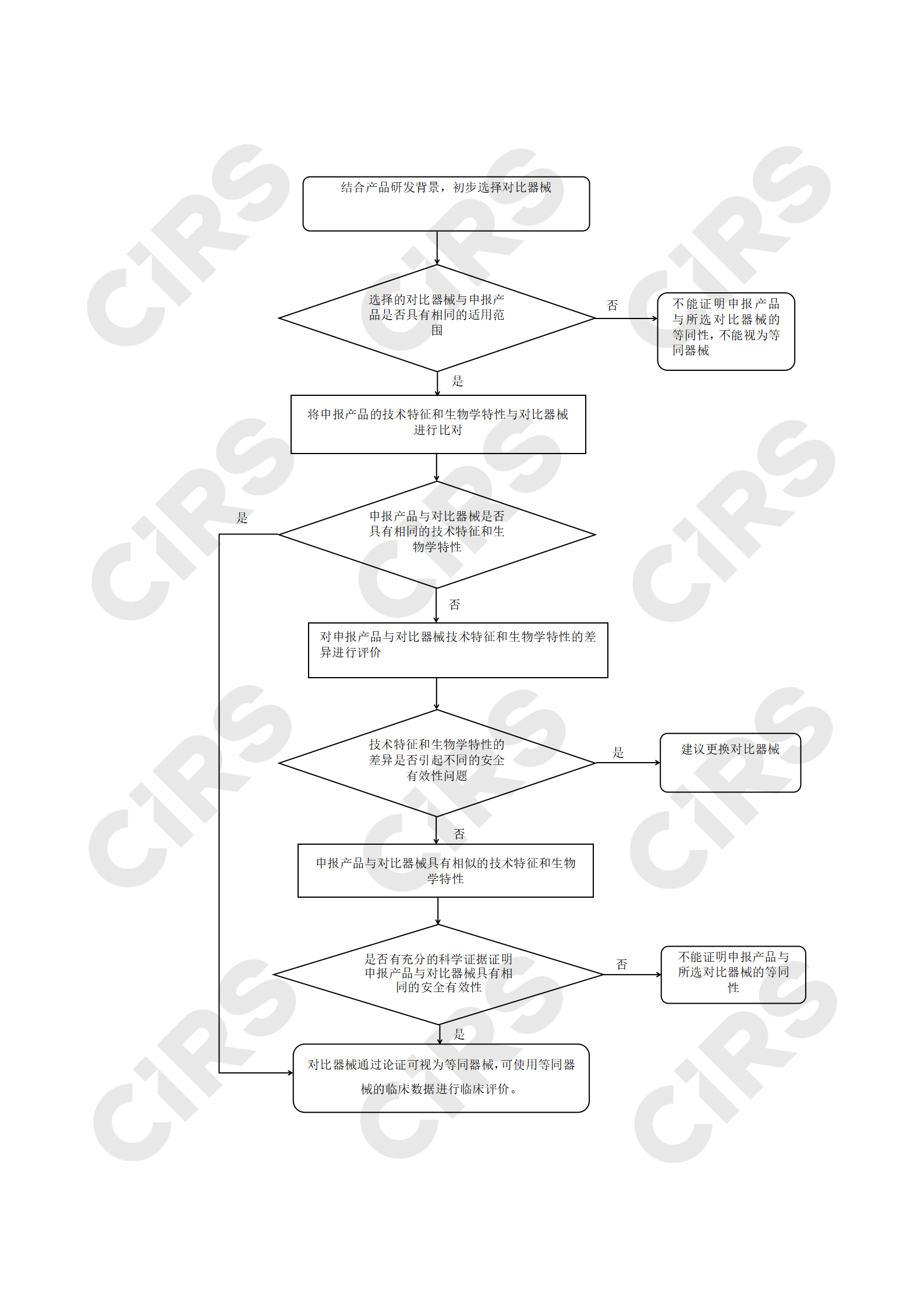
等同性論證既是判斷申報產品與選擇的對比醫療器械是否等同的過程,對比產品若能通過論證證明其與申報產品基本等同,對比產品視為申報產品的等同產品,可進行同品種臨床評價。
等同性評價主要包括三方面,適用范圍等同性判定、技術特征等同性判定、生物學特性等同性判定,具體等同性判定流程見附錄。
一、等同性判定過程
1、適用范圍等同性判定
進行等同性論證的產品首先應具有相同的適用范圍,基于相同的適用范圍,進一步在技術特征和生物學特性方面進行比對,證明二者基本等同。因此首先要對產品的適用范圍進行對比,這里的適用范圍不僅局限于注冊證載明的預期用途,還要考慮適應人群等信息。適用范圍的對比項目包括以下11個方面(不適用的除外):
(1)適應證:包括器械預防、診斷、緩解、治療或者監護的疾病或癥狀;
(2)適用人群:如年齡、性別、體重等對適用人群的限定;
(3)適用部位:如臨床應用的具體人體部位、器官、組織、體液等;
(4)與人體接觸方式和時間:如植入或體表接觸、接觸時間、接觸次數等;
(5)疾病的嚴重程度和階段:如疾病的名稱、分型、分期、嚴重程度等;
(6)使用條件:如使用環境(家用、醫院、具體科室、手術室、救護車等)、配合使用的器械或藥品、使用者要求等;
(7)重復使用:如可否重復使用、可重復使用的次數和時間等;
(8)使用方法;
(9)禁忌證;
(10)警告及預防措施;
(11)其他。
通過比較申報產品與對比器械的適用范圍及臨床使用相關信息的,對二者差異進行識別、闡述和評價,判定適用范圍是否相同。當適用范圍差異導致兩者風險有明顯差異時,臨床安全有效性具有顯著差異,認為對比器械與申報產品的適用范圍不同。需要注意的是,適用范圍的差異并不一定會導致適用范圍的不同,例如申報產品與對比器械適應癥有差異但屬于同性質使用,可認為二者具有相同的適用范圍。企業應對適應癥差異性不導致預期用途差異提供充分的同質性闡述。
2、技術特征、生物學特性的對比
在確定申報產品與對比醫療器械具有相同的適用范圍后,注冊申請人需提供技術特征和生物學特性的充分信息并對其逐項對比。
(1)技術特征包括:
①設計信息:
-工作原理、作用機理;
-器械設計特征及依據:如組成、材料、產品結構的表征(可根據產品特征,選擇適用的方式,包括結構圖、三視圖、爆炸圖、局部細節放大圖、工程圖等)、尺寸和公差、軟件等;
-申報器械的重大特性,明確其在整體設計和適用范圍下的用途;如果沒有明確的用途,應重點詳述特定的設計或組件如何促進申報器械的整體使用和功能。
②材料:
-部分產品尤其是植入性醫療器械由于與人體組織直接接觸,需明示組成材料詳細、完整的化學組成,識別添加劑,如著色劑、涂層或其它表面改性劑等;
-部分產品的材料加工方式(如鍛造或鑄造)及其狀態(如無定形或結晶)可能影響產品的安全有效性,適用時需考慮列出;
-除醫療器械常見組成材料外,部分產品可能涉及生物制劑、藥物、涂層、添加劑等。
③能源:如對器械的能源傳遞(如電池的使用),作為器械功能方面的一部分且對使用產品的患者和/或醫務人員有影響的能源傳遞(如X射線、激光、射頻、超聲)等。
④產品性能、功能及其他關鍵技術特征:
-從測試方式角度,如實驗室測試、計算機模擬、動物試驗、其他模擬臨床使用的非臨床研究等。
-從技術特征角度,如疲勞、磨損、抗拉強度、壓迫、流量、爆裂壓力、軟件/硬件特性、軟件核心算法、密度、孔隙度、體外降解特性、試驗方法的原理等。
生物學特性主要包括:如降解性能、生物學反應(如免疫反應、組織整合等)等。
在論證等同性或分析差異時,注冊人應提供相應的支持性資料作為安全有效性等同的有效科學證據,如技術要求、說明書、文獻研究等,一般性描述通常不足以作為支持證據。支持性資料通常需包括準確、可靠、完整、可追溯的數據,必要時包括數據的產生過程,試驗/實驗數據建議來自有良好質量控制的實驗室。
通過等同性論證的對比產品一般為如下兩種情形:
申報產品與對比器械具有相同的適用范圍、技術特征和生物學特性;
申報產品與對比器械具有相同的適用范圍,相似的技術特征和生物學特性;有充分的科學證據證明申報產品與對比器械具有相同的安全有效性。
二、等同性判定中的問題
1、等同性論證時,由于產品功能、設計不同,存在需要與多個產品進行臨床評價的情況,比如產品的功能模式涵蓋了多個產品的功能,此時可根據功能模塊或模式分別與不同的對比產品對比;但應選擇與申報產品盡可能相似的產品作為對比器械。
2、當對比產品與申報產品有技術特性差異時,某一方面的差異是否引發不同的安全有效性問題,因具體產品和不同情形而異。產品與選定的對比產品在某一技術特性上有差,但已上市其他的產品(適用范圍相同)中有與申報產品相同的技術特征,此時,注冊人可以通過相關支持資料論證差異性不影響安全有效性,論證是否充分受差異大小和支持性資料的影響。
3、臨床評價中等同器械的資料內容
表1對比器械的基本信息
對比項目 | 對比器械1 | 對比器械2(如有) |
產品名稱 | ||
注冊證號 | ||
結構組成 | ||
適用范圍 | ||
生產企業 | ||
技術特征 |
表2申報產品與對比器械的對比表
對比項目 | 申報產品 | 對比器械 | 相同性/差異性 | 支持性 資料概述 (可以附件形式提供) |
適用范圍 | ||||
1. | ||||
2. | ||||
3. | ||||
... | ||||
技術特征 | ||||
1. | ||||
2. | ||||
3. | ||||
... | ||||
生物學特性 | ||||
1. | ||||
2. | ||||
3. | ||||
... |
表3針對差異性部分的科學證據列表
編號 | 證據內容概述 (非臨床/臨床) | 論證的問題 |
1 | ||
2 | ||
3 |
附錄:等同性判定流程