
各有關單位:
根據國家藥品監督管理局醫療器械注冊審查指導原則制修訂的有關要求,我中心對《可重復使用醫療器械再處理驗證方法和標識注冊技術審查指導原則(一)》和《可重復使用醫療器械再處理說明和確認方法注冊技術審查指導原則(二)》進行了修訂完善,制定了《可重復使用醫療器械再處理說明和確認方法注冊審查指導原則(征求意見稿)》,經調研、討論,現已形成征求意見稿(附件1),即日起在網上再次公開征求意見。
如有意見和建議,請填寫意見反饋表(附件2),以電子郵件的形式于2023年12月8日前反饋至我中心。郵件主題及文件名稱請以“《可重復使用醫療器械再處理說明和確認方法注冊審查指導原則(征求意見稿)》意見反饋+反饋單位名稱”格式命名。
聯系人:呂英賀
聯系方式:0755-8308 7056
電子郵箱:lvyh@cmde.org.cn
附件:1.可重復使用醫療器械再處理說明和確認方法注冊審查指導原則(征求意見稿)
2.意見反饋表
國家藥品監督管理局
醫療器械技術審評中心
2023年11月7日
如需下載原文請掃描一下二維碼

可重復使用醫療器械再處理說明和確認方法
注冊審查指導原則(征求意見稿)
本指導原則旨在指導注冊申請人提交可重復使用醫療器械再處理說明和確認方法的申報資料,同時規范可重復使用醫療器械再處理有關內容的技術審評要求。
本指導原則是對可重復使用醫療器械再處理說明和確認方法的一般性要求,注冊申請人應根據醫療器械產品特性提交相應的申報資料,判斷指導原則中的具體內容是否適用,不適用內容詳述理由。注冊申請人也可采用其他滿足法規要求的替代方法,但應提供詳盡的研究資料和驗證資料。
本指導原則是在現行法規和標準體系以及當前認知水平下、并參考了國外法規、指南、國內外標準和技術規范等制定的。隨著法規和標準的不斷完善,以及認知水平和技術能力的不斷提高,相關內容也將適時進行修訂。
本指導原則是對注冊申請人和審評人員的指導性文件,不包括審評審批所涉及的行政事項,亦不作為法規強制執行,應在遵循相關法規的前提下使用本指導原則。醫療機構進行醫療器械的再處理應同時遵守相關部門規定。
一、適用范圍
本指導原則適用于可重復使用的醫療器械,主要包括以下兩種情形:
(一)最初以無菌形式提供給用戶,并且要求用戶在首次使用后、后續患者再次使用前,進行再處理(即清潔、消毒或滅菌)的可重復使用醫療器械。
(二)最初以非無菌形式提供給用戶,并要求用戶進行處理(即清潔、消毒或滅菌)以供首次使用,并在每次使用后進行再處理的可重復使用醫療器械。
僅由單個患者使用,并且預期在每次使用之前需進行再處理的可重復使用醫療器械也適用于本指導原則。以非無菌形式提供,并要求用戶在使用前進行處理的一次性使用的醫療器械可參照本指導原則中適用的部分。此外,按照本指導原則中的再處理說明的要求可能不足以殺滅朊病毒,注冊申請人應提醒用戶按照其他相關規定對預期可能與朊病毒接觸的器械進行處理。
本指導原則并未針對某具體的醫療器械提供設計、測試或者再處理確認方面的建議,如有關專用指導原則針對某具體的醫療器械提供了相關建議,注冊申請人應遵守專用指導原則。
二、基本原則
(一)可重復使用醫療器械的一般要求
1.設計要求
可重復使用醫療器械的設計應便于用戶進行方便和有效的清潔以及必要的消毒或滅菌。一些復雜的器械設計(例如管腔內軸構造、分離器通道、精細通道、密封件和接合關節表面)對清潔和清潔確認提出了特殊要求。在器械的早期設計開發階段,注冊申請人應考慮便于進行有效再處理的設計優化(例如,將難以進行再處理的部件設計為一次性使用、設計沖洗孔、明確和/或提供專用清潔附件等)。
2.確保可重復使用醫療器械的安全性
可重復使用器械的注冊申請人和用戶在確保醫療器械再處理的安全性和有效性方面都發揮重要作用。注冊申請人應充分明確再處理的信息,例如為用戶提供再處理應采用的方法、設備、參數等信息。同時注冊申請人應根據醫療器械生產質量管理規范的要求,在體系文件中保留相關再處理信息的測試文件、數據、記錄等內容,證明再處理的信息已經過確認并易于用戶理解且具有可操作性。
(二)再處理說明的一般考慮
再處理是將使用過的或被污染的醫療器械進行處理以滿足后續使用要求的經確認的過程。再處理通常包括清潔、消毒或滅菌,清潔過程用于去除污染,消毒或滅菌用于殺滅微生物。可重復使用器械的再處理從預處理開始,通常包括以下三個步驟:
1.預處理:為了后續更好地清潔,再處理從預處理開始。預處理包含使用后及時的初步清潔步驟或措施,主要目的是防止器械內部和外部的污染物干固。
2.徹底清潔:在預處理后,應徹底清潔器械。通常,應在專用清潔區域進行徹底清潔。在使用期間可能不會被病原體污染的器械(例如血壓計袖帶、聽診器等)通常不需要消毒或滅菌,因此清潔后即可使用。
3.消毒或滅菌:根據器械的適用范圍,器械應進行消毒或滅菌,以供再次使用。
再處理的流程概述如圖1所示,附件2中提供了各再處理步驟的詳細概述。在某些情形下(如器械被傳染病病原體污染),在滅菌處置之前需要對器械進行消毒,這類情形不在本指導原則的考慮范圍之內。
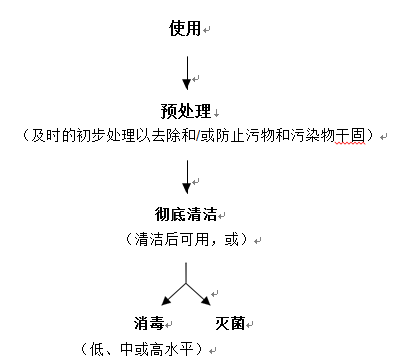
圖1 流程概述
需要注意的是,清潔、消毒和滅菌是完全不同的過程。
清潔是通過物理或化學方式去除污物;所采用的清潔方法和醫用清洗劑應能有效去除污物。有效的清潔應滿足以下幾個要求:
最大程度減少污染物在每次使用間的轉移;防止殘留污物在產品的使用壽命內的積聚;滿足后續消毒或滅菌步驟的需要。
消毒和滅菌目的是減少或殺滅微生物,所采用的消毒或滅菌的方法和試劑應能達到相應的消毒或滅菌效果。有關消毒和滅菌的定義,請參考附件1;有關消毒和滅菌過程的具體信息,請參見本指導原則五(五)3的內容。
因此,清潔步驟應獨立于消毒或滅菌進行單獨確認。
三、清潔過程的確認
對再處理說明中清潔過程進行確認的目的是:該方法(手動或自動)能使器械滿足進行下一步處理的要求,并最終可安全重復使用;用戶應能正確理解再處理說明中的內容并執行相應的步驟。
(一)應在最不利情況下確認清潔過程
注冊申請人應對其再處理說明中的清潔過程進行確認。清潔確認方案的設計應綜合考慮產品的預期用途及臨床使用時可能受到的污染情況(污染物種類),應包括清潔過程的最不利情況(如清洗最困難,污染最多時的狀態等),并至少采用一種與臨床污染物有關的定量試驗方法。清潔確認方案應明確測試終點,并且能確保該器械最難以清潔的部分通過常規的清洗能夠達到預期的清潔效果。對于所有試驗,都應選擇合理的樣本量以證明試驗的有效性。
1.人造污染物、接種部位和模擬使用
再處理確認中應包括完整的模擬使用測試方案。
1.1人造污染物
注冊申請人應選擇一種人造污染物進行測試。人造污染物的成分應能代表其在臨床使用時可能接觸到的污染物,并且對清潔過程最具挑戰性。例如,喉鏡在檢查時可能會接觸血液和粘液,因此,為了模擬最難以清潔的情況,人造試驗污染物應為多組分污染物,其中包括模擬血液和粘液的物質。對血液或粘液進行單獨的清潔確認不能代表最不利情況下的挑戰,因為血液和粘液的混合物更難清潔。所選擇的人工試驗污染物應對至少一種具有代表性的臨床相關污染物成分進行定量試驗(例如,總有機碳或蛋白質)。
不建議將孢子(或任何其他微生物)對數減少試驗用于確認清潔方法的有效性。關于孢子(或任何其他微生物標記)對數減少值與器械有機物污染去除效果之間的直接相關性,目前還缺少足夠的科學證據。微生物的對數減少只能表明再處理過程降低了微生物的數量并不能表明其他有機物污染也降低了。
1.2接種部位
污染物接種應模擬最不利情況的臨床使用條件。應在器械上所有可能接觸患者材料的部位接種人造污染物,包括所有難以清潔的位置。
1.3模擬使用條件
設計清潔確認方案時,應考慮模擬使用條件,特別是對于因重復使用而導致污染物累積的器械,應采用經歷過多次模擬使用后的器械。清潔效果的確認應進行多個完整的使用循環,并用于評估污染物累積情況。模擬使用循環次數應合理。
模擬使用試驗過程應與實際使用狀態一致,以模擬最不利情況下的臨床使用條件(例如,最不利情況持續時間)。為了試驗時能充分的對器械進行污染,應對器械所有預期的功能或動作進行操作(如重復連接、彎曲等),對于在臨床使用時需通電、加熱的器械(如電動牙科手機和高頻手術器械),在模擬使用時也應同樣模擬這些情況。如果在重復使用過程中會將污物推入器械中更難清潔的部位,則確認的過程應復現這種最不利的情形。如果臨床使用后無法立即清潔導致污染物可能干固(例如,沒有經過充分處理的外來器械),進行方法確認時應模擬污物干固的最不利情形(最長的時間)。
對照組器械應以與試驗組器械完全相同的方式進行制備;陽性對照器械應被污染,陰性對照器械不得污染。
2.確認方案:測試清潔過程的方法
確認方案應明確清潔過程中的時間、溫度和濃度等參數。
清潔確認方案應在清潔說明的每個步驟中明確最短時間、最低溫度、最低的稀釋度等,應能代表所有最不利情況下的再處理條件。且清潔確認方案應將這些最嚴格的條件用于清潔說明的每個步驟。注冊申請人應對再處理說明中的清潔方法和確認方案中的清潔方法進行詳細的并行比較,以確定和說明所有最不利情況下的處理條件。
最不利情況再處理條件的示例:
如果清潔說明建議進行10至20分鐘預浸泡,確認方案應規定10分鐘。
如果清潔說明建議用戶在45ºC±5ºC下進行手動清潔,確認方案應規定在40ºC下進行清潔。
酶洗滌劑:一般情況下,“最不利情況”意味著最短時間、最低溫度等。但酶洗滌劑例外,其通常具有“最佳有效”的溫度范圍。確認方案應考慮酶洗滌劑清潔說明中規定的溫度范圍。
醫用清潔器/消毒器:如果清潔過程使用了自動清潔器/清洗消毒器或超聲清潔器,則最不利情況應包括自動清潔器/清洗消毒器或超聲清潔器的預期循環參數的極限值。
如果器械構成中包含必須在清潔過程中沖洗的管腔、端口或通道,則確認方案應包括最小的沖洗參數,例如時間、沖洗量或流量以及重復次數(例如,10 mL沖洗,執行 3次)。
3.試驗:試驗類型和方案
3.1選擇試驗類型
建議至少使用一種能夠直接測量有臨床意義的相關污染物的定量試驗方法。選擇試驗方法時,應考慮多個因素,包括但不限于:在實際臨床使用期間器械預期接觸的污染物、臨床相關污染物成分的試驗特異性,以及試驗方法與擬定清潔終點間的靈敏度。
無論選擇何種試驗類型,在確認過程中都應對器械的外表面和內表面進行目視檢查。
注冊申請人應提供試驗類型的選定理由,可參考國內外相關標準、已發表的文獻、已公開的測定方法等。如果注冊申請人選擇的試驗方法與以上內容有差異,應提供相應理由(可參考GB/T 35267、YY/T 0734系列標準等)。
3.2方法確認
注冊申請人應對測試污染物殘留量的試驗方法進行確認。試驗方法應包括分析靈敏度和特異性信息,以及擬定的清潔終點,并設置對照組。
建議對照組的設置如下:
陰性器械對照:器械應未污染,并經受與試驗器械相同的清潔和提取。殘留污染物的量應等于或略高于陰性樣本對照。
陽性器械對照:使用已知量的污染物污染器械,但不對其進行清潔,然后提取殘留污染物。殘留污染物應等于或稍低于所接種的污染物量。在計算時應使用污物回收率校正結果。
陰性樣本對照:“提取”應在未使用任何器械的情況下進行。此樣本用作空白對照。
陽性樣本對照:在未使用任何器械的情況下將已知量的污染物(等于或略高于定量限度)添加到“提取物”中。
3.3提取方法
注冊申請人應確認回收器械殘留污染物的提取方法,并應確定回收率。確定回收率常使用極限提取和使用已知量的污染物進行提取的方法。提取應對所有表面進行采樣,包括內表面(如管腔)和接合表面。在確定回收率試驗時,應明確具有最不利情況挑戰(最難去除)的被污染部件。應確保用于從器械中去除試驗污物的提取量不過大,否則會使用于測定的試驗標記物被稀釋到檢測水平以下。
一些器械的設計會包含在使用過程中可能被污染但在清潔和提取過程中難以接觸的較復雜內部結構(例如管腔、內部移動部件)。因此,應設計清潔方法和拆卸方法以接觸這些表面。對于此類在結構上較為復雜的器械,在提取方法確認和器械清潔確認中,應對所有相關的內部表面區域進行采樣。因此,在確認研究中,可能需要額外的拆卸過程,以便從這些難以接觸的區域充分提取殘留污染物。這種額外拆卸一般不需要對基本構成組件進行進一步拆解或者破壞產品結構。
對于包含預期不與臨床污染物和液體接觸的內腔/內部密封結構的器械,應證明清潔液、沖洗水和/或人體的組織、體液等不會通過不完整的密封、接縫或其他內外連通氣室滲入器械的內部。
如果確定存在臨床污物或清潔液侵入的風險,則應證明清潔方法可滿足器械使用期限內任何時候被污染的所有內部表面的清潔終點。
(二) 確定模擬使用方案的資源
建議在清潔過程的確認中使用最不利情況下的模擬使用方案。在適用的情況下,建議可咨詢臨床醫生,以確定實際的、最不利情況下的器械污染的程度和性質。此外,在確定再處理方案時,應考慮可操作性和人為因素問題。
四、消毒/滅菌過程的確認
(一)消毒/滅菌確認流程如下圖所示:
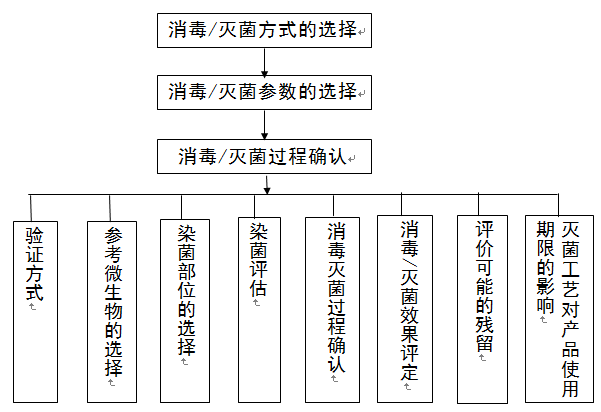
圖2 消毒/滅菌確認流程圖
(二)消毒/滅菌方式的選擇
注冊申請人應評價消毒/滅菌方式的適宜性,包括消毒/滅菌因子的適應性、對器械性能以及對器械材料的物理和/或化學等方面的影響,例如,選擇高溫壓力蒸汽滅菌時需考慮壓力變形、熱塑等影響;選擇化學消毒劑消毒時,需考慮化學腐蝕、材料兼容、消毒劑殘留等影響。
不應使用工業滅菌方式替代醫療機構臨床滅菌方式進行確認。
(三)消毒/滅菌過程參數的選擇
注冊申請人應對消毒/滅菌過程參數進行確認。消毒/滅菌過程參數可以是下列因素按照特定順序的一種或多種組合:
1.消毒/滅菌因子的濃度;
2.溫度;
3.作用時間;
4.作用壓力;
5.濕度;
6.其他影響因素。
為保證有效的消毒/滅菌過程,若需要,應確認消毒/滅菌過程的前處理、后處理,如:
——可重復使用醫療器械消毒/滅菌前應進行的處理,如浸泡、保濕、清潔、清洗、干燥、包裝、器械的數量或裝載量、擺放位置、用于達到裝載量的輔助器械的選擇等內容;
——可重復使用醫療器械消毒后的處理,如終末漂洗、干燥、轉運、存放、包裝等內容;
注:干燥可結合五(五)5.11“干燥”的內容;
——可重復使用醫療器械滅菌后的處理,如存放、通風等內容。
(四)消毒/滅菌過程確認
1.確認方式
為最大限度的模擬可重復使用醫療器械的實際使用時的最不利條件,消毒/滅菌驗證過程建議采用器械染菌的驗證方式,不建議采用A0值、自含式生物指示物或化學指示物等其他方式進行驗證。
2.參考微生物的選擇
根據不同的器械的預期用途、風險水平、消毒等級、消毒/滅菌過程的抗力、器械自身生物負載的抗力等因素,注冊申請人應確認參考微生物的代表性,并且微生物的抗力符合相關標準的要求。
3.染菌部位的選擇
注冊申請人應指定染菌部位,并闡述理由。染菌部位的選擇原則應能模擬最不利的臨床使用條件,并易于測試。
4.染菌評估
注冊申請人應確認用于驗證的可重復使用醫療器械上的參考微生物數量,如,用于消毒驗證的可回收參考微生物數量應不小于1×105CFU/件,用于滅菌驗證的可回收微生物數量不小于1×106CFU/件,并應規定合適的陰性對照和陽性對照。
5.消毒/滅菌過程確認
注冊申請人應確認消毒/滅菌過程,并制定相應的方案,并使用挑戰過程來進行確認,用以模擬臨床消毒/滅菌過程中的最不利條件。通常可使用少于說明書規定的常規消毒/滅菌作用時間作為挑戰,如說明書規定的常規蒸汽滅菌過程為121℃,30分鐘,挑戰驗證工藝可選擇121℃,20分鐘;說明書規定的器械常規消毒過程為12至15分鐘,挑戰驗證工藝可選擇說明書中要求的最短時間,即12分鐘。
確認后的消毒/滅菌參數方應標注在說明書中,注冊申請人在說明書中也應注明:若使用者在使用環節對參數進行調整,如降低消毒劑濃度、增加負載數量、降低處理溫度、減少處理時間,則新參數必須經過確認后方可使用。
6.消毒/滅菌效果評定
消毒/滅菌效果通過具體殺滅對數值/無菌保證水平進行評定,注冊申請人應根據可重復使用醫療器械與人體接觸的部位、接觸污染物的種類及數量、可能導致的風險程度等因素綜合考慮。
器械進行一個消毒過程后,微生物的殺滅對數值至少為3,在某些情況下應要求更高的殺滅對數值。注冊申請人應根據不同的消毒水平選擇適用的微生物種類和確定微生物殺滅對數值要求,并提供選擇依據。
器械經已確認的滅菌方法滅菌后,無菌保證水平(SAL)應能達到 10-6。
7.評價可能的殘留(如適用)
為確保器械在預期使用的安全,應評估消毒/滅菌因子在使用中或使用后,可能的殘留物質對可重復使用醫療器械和患者的潛在影響,殘留的消毒/滅菌因子濃度不超過消毒/滅菌劑制造商規定的水平,并應有相應的控制措施,這些措施可包括多次漂洗、加熱解析、滅菌劑強制排除、強制通風等方式。
8.滅菌工藝對產品使用期限的影響
對可耐受兩次或多次滅菌的可重復使用醫療器械,注冊申請人應確認滅菌次數或使用期限,可以向使用者提供使用壽命終止的指標/指示物,或者提供給使用者每次滅菌后進行器械性能檢驗的方法和接受準則。可參考五(五)5.12項“重復使用壽命”的內容進行確認。
五、注冊申報資料要求
本指導原則未提及的注冊申報資料應符合《關于公布醫療器械注冊申報資料要求和批準證明文件格式的公告》的要求。
可重復使用醫療器械再處理說明中的內容都應經過確認。再處理說明的確認方案和報告應在產品申報資料的“清潔、消毒、滅菌研究”中提供。
表1列舉了部分難以進行再處理的醫療器械產品結構設計特征,具有符合表1產品結構設計特征的器械或表2列舉的器械,在注冊申報時應按照本指導原則要求提供完整的再處理說明確認方案及確認報告。對于未列入表1和表2中,但在注冊申報時若有其他法規、規范性文件規定或在審評時認為需要提供完整的再處理說明確認方案及確認報告的器械,也應按照本指導原則要求提供相應的資料。對于其他情形,如基于同類/類似產品使用經驗、不良事件監測、召回數據或風險管理過程的結果認為有必要的,也可參考本指導原則適用的部分提交研究資料。
(一)清潔確認方案的要求
清潔確認方案應至少包含以下內容:
1.基本信息
1.1試驗產品信息
明確產品的名稱、型號規格、適用范圍、結構組成等。
如注冊單元中包含多個型號,應說明所選取的典型性試驗產品的型號以及選擇的依據;
1.2清潔類型
應說明本次確認的清潔類型:手動和/或自動。清潔類型應能覆蓋說明書中提供的清潔類型;
1.3清潔工具
如果注冊申請人提供用于本產品的特定清潔工具,應提供完整的清單以及其作用;
1.4清潔劑
應列明本次試驗所使用的清潔劑,包括名稱,類型,生產商及相關的許可證編號(如適用)。清潔劑應能代表說明書中指定的清潔劑的類型,應對選擇的清潔劑進行論證。
1.5清潔器
如果清潔類型為自動清潔,請列明確認適用的清潔器的名稱、型號、生產商以及醫療器械注冊證編號。
2.污染
2.1人造污染物
應指定人造污染物的成分,包括所有的組分以及每一個組分的濃度。人造污染物應能代表試驗產品在實際臨床使用過程中接觸的物質,并且應最難以清潔。不建議使用微生物作為污染物,因為微生物標記物的清除不能代表有機污染物的清潔效果。注冊申請人應提供人造污染物選擇的論證。
2.2污染部位
應指定污染部位,污染部位應為產品最難以清潔的部分。如果有多個與人體接觸的部位,建議污染所有的部位。注冊申請人應提供污染部位選擇的論證。
2.3污染方式
應說明如何使用人造污染物對試驗樣品進行污染的過程。
3.組別設置
應設置試驗樣品組、陰性器械對照組、陽性器械對照組、陰性樣本對照組和陽性樣本對照組。對照組的制備應符合本指導原則清潔過程確認部分三(一)3.2的要求。應明確每個組別設置的具體方式,包含樣本量。
4.清潔方法
應明確常規清潔方法和確認用清潔方法。確認用清潔方法應采用最短時間、最低溫度、最低的稀釋度等最不利的條件進行。方案應對常規清潔方法與確認用清潔方法對比,說明并論證其差異。常規清潔方法應與說明書的清潔方法保持一致。
5.確認過程
5.1應明確確認的詳細過程;
5.2應明確污染物殘留的收集方式;
5.3應對污染物殘留的收集方式進行確認;
5.4應明確污染物殘留的檢測指標;
5.5應明確污染物殘留檢測指標的測試方法;
5.6應對測試方法進行方法確認。
6.評價方法
應明確結果的計算方式以及針對指定的污染物殘留檢測指標,建立接受準則。注冊申請人應論證接受準則的合理性。
(二)消毒確認方案的要求
消毒確認方案應至少包含以下內容:
1.基本信息
1.1試驗產品信息
明確產品的名稱、型號規格、適用范圍、結構組成等。
如注冊單元中包含多個型號,應說明所選取的典型性試驗產品的型號以及選擇的依據。
1.2消毒類型和消毒等級
應說明本次確認的消毒類型:手動和/或自動,化學和/或熱力學消毒;消毒類型應能覆蓋說明書中提供的消毒類型和消毒等級。
1.3消毒工具
如果注冊申請人提供的,用于本產品特定的消毒工具,應提供完整的清單以及其作用。
1.4消毒劑
應使用已合法上市的消毒劑,同時列明本次試驗所使用的消毒劑,包括名稱,類型,等級(高效,中效或低效),生產商及生產商許可證編號。消毒劑應能代表說明書中指定的消毒劑的類型,應對選擇的消毒劑進行論證。
1.5消毒機
如果消毒類型為自動消毒,請列明確認適用的消毒機的名稱、型號、生產商以及醫療器械注冊證編號。
2.接種
2.1菌種的選擇
應指定確認過程中使用的菌種。菌種應對所選擇的消毒類型和/或消毒劑等級最具挑戰。注冊申請人應提供菌種選擇的依據并符合我國相關要求。
2.2接種部位
應指定接種部位,接種部位應為產品最難以消毒的部分。如果有多個與人體接觸的部位,建議接種所有的部位。注冊申請人應提供接種部位選擇的論證。
2.3接種方式
應說明如何使用微生物對試驗樣品進行接種的過程。
3.組別設置
至少應設置試驗樣品組、陰性器械對照組、陽性器械對照組。對照組的制備應符合本指導原則清潔過程確認部分三(一)3.2的要求。應明確每個組別設置的具體方式,包含樣本量。
4.消毒方法
應明確常規消毒方法和確認用消毒方法。確認用消毒方法應采用最短時間、最低溫度、最低的稀釋度等最不利的條件進行。方案應對常規消毒方法與確認用消毒方法對比,說明并論證其差異。常規消毒方法應與說明書的消毒方法保持一致。
5.確認過程
5.1應明確確認的詳細過程;
5.2應明確微生物的收集方式;
5.3應對微生物的收集方式進行確認;
5.4應明確微生物定量分析的檢測方法;
5.5適當時,說明中和方法,并對中和方法進行確認;
5.6適當時,應包括消毒劑殘留評價。
6.評價方法
應明確結果的計算方式,建立接受準則。注冊申請人應論證接受準則的合理性。
(三)滅菌確認方案的要求
滅菌確認方案應至少包含以下內容:
1.基本信息
1.1試驗產品信息
明確產品的名稱、型號規格、適用范圍、結構組成等。
如注冊單元中包含多個型號,應說明所選取的典型性試驗產品的型號以及選擇的依據;
1.2滅菌方法
應說明本次確認的滅菌方法;
滅菌方法應覆蓋說明書中提供的滅菌方法;
1.3滅菌器
請列明確認使用的滅菌器的名稱、型號、生產商以及醫療器械注冊證編號。滅菌器應為醫療機構可使用的滅菌器。
1.4滅菌包裝材料
若滅菌前需要包裝,應提供正確包裝的信息(如材料、成分和尺寸等)。
2.確認過程
滅菌確認過程應遵循適當的國家或者行業標準。
(四)確認再處理方法時的典型性產品選擇
如設計、材料和其他因素相似,可建立產品族(例如具有一系列可用尺寸的器械組),以盡量減少再處理的確認工作。也就是說,產品族中最難再處理的器械的確認數據(即,最不利情況下的器械或“典型器械”)可涵蓋再處理難度等同或更容易的器械。如果采用了這種方法,則應評價在產品族中再處理較容易的器械的所有設計特征,例如與典型代表器械的再處理挑戰相關的管腔長度和直徑、材料、結構和質地,并確保其與典型代表器械再處理相比挑戰性較小。任何可能影響滅菌劑滲透或效力的設計或材料的變化都可能導致需要進行重新確認。如果使用了典型代表器械,則應記錄相關正當理由的支持性信息。
(五)再處理說明的要求
注冊申請人應提供給用戶包含再處理信息的說明,即再處理說明。再處理說明應符合以下六項要求。
1.說明中應體現器械的適用范圍
再處理方法應考慮器械的物理設計、適用范圍以及在臨床使用期間可能受到的污染情況。適當的再處理說明取決于器械是否:
僅接觸患者完整皮膚;
接觸患者完整的黏膜表面;
接觸患者無菌組織、血液或體液(如腦脊液,腹膜液,房水等);
盡管不與患者直接接觸,但由于臨近患者,將可能有體液或血液的飛濺;
使用過程中,可能由于接觸患者或醫護人員受污染的手部而造成污染(需注意的是,未洗凈戴手套的手可能將有機污物和微生物轉移至其觸碰的物品表面);
將因意外事件(例如患者出血、失禁、嘔吐等)而導致的污染;
由于未經充分漂洗導致有害物殘留,或采用了可能對器械材料或性能造成不利影響的消毒滅菌方法、試劑;
給患者或用戶帶來特定風險。
2.再處理說明應建議用戶徹底清潔器械
應在再處理說明中明確清潔是再處理的首要環節,清潔的效果將影響最終消毒和滅菌的效果。再處理說明中應明確進行徹底清潔的方法,清潔步驟的詳盡程度根據器械的復雜程度決定。
難以進行徹底清潔或者具有可能導致污染物殘留的結構特征的器械在清潔時可能需要進行拆解,除非注冊申請人能證明在不拆解的情況下可以完成清潔效果的確認(即,應對比在拆解狀態及未拆解狀態下進行清潔驗證的數據)。此外,對于此類器械,清潔說明中應提供適當拆解圖示及說明(詳見本指導原則第五(五)5.3的要求)。
注冊申請人可以選擇使用保護套等措施以減少器械在清潔時的復雜度。如果使用保護套,應明確僅能使用已經合法上市的產品。同時,清潔說明應包含在未使用保護套時使用器械的情況,因為在使用過程中保護套可能受損導致失效,而保護套的破損難以識別,同時一旦發生破損情況容易對器械造成污染。
可沖洗器械(例如內窺鏡,腹腔內窺鏡手術器械和具有沖洗口的其他器械)容易產生污染物堆積,在清潔說明中應提供合適的沖洗方法(必要時可以配圖)。充分的沖洗對于去除器械內部殘留的污染十分重要。沖洗方法中應包含有關如何正確沖洗器械、需使用的相關附件(如與沖洗口尺寸適當的連接器、清洗刷等)以及用于確保有效清潔所使用的沖洗劑等內容的有關信息。
3.再處理說明應明確器械適用的消毒滅菌方法
再處理說明應符合感染控制管理規范的要求。注冊申請人應根據器械的適用范圍來確定相應的消毒(高、中、低水平)或滅菌方法。需要注意的是,無論采用何種消毒或滅菌方法,注冊申請人都應確認其與器械的兼容以及其可有效進行再處理,并在使用說明中進行說明。再處理過程的確認應證明經再處理后能有效去除污染物并且達到預期的消毒或滅菌效果。
依據斯波爾丁分類原則,可以將器械分為高度危險性、中度危險性和低度危險性器械,并根據其可能引起的潛在感染風險程度對其需要的再處理過程給出建議。
3.1高度危險性器械
指直接進入人體血液循環系統、接觸無菌組織或體腔的醫療器械。如果醫療器械達不到無菌效果可能會有微生物傳播導致感染風險,應要求用戶在每次使用后進行拆解(如適用)、徹底清潔并對其進行滅菌。
高度危險性器械的示例:如手術器械、穿刺針、腹腔鏡、心臟導管和內窺鏡活檢附件。
3.2中度危險性器械
中度危險性器械是指接觸完整黏膜或不完整皮膚的器械,這類器械不侵入人體組織或者人體無菌部位。盡管完整黏膜通常可以抵御少量的孢子進入,仍應通過再處理過程去除這類器械上的所有形式的微生物。應要求用戶徹底清潔這些器械,然后通過滅菌對其進行再處理。如果器械設計不允許進行滅菌(例如,器械材料不能經受滅菌),則應使用高水平的消毒。
中度危險性器械的示例:如壓舌板和肛門直腸壓力測量導管等。
耐熱器械(如硬性內窺鏡)宜通過蒸汽滅菌來進行再處理。對于不耐熱器械,可用“低溫”再處理方式,包括過氧化氫低溫等離子體滅菌、低溫蒸汽甲醛滅菌、環氧乙烷(EO)滅菌和液體化學滅菌或高水平消毒等方法。
3.3低度危險性器械
低度危險性器械是與完整皮膚接觸而不穿透皮膚的器械。低度危險性器械還包括不直接接觸患者但在患者護理期間可能被污染(例如遭受血液、體液飛濺)的器械;視覺上看,此類器械的污染可能并不明顯。應要求用戶進行徹底清潔,然后根據污染的性質和程度進行中等水平或低水平消毒。
低度危險性器械的示例:如血壓袖帶、聽診器和皮膚電極等。不直接接觸患者但在患者護理期間可能被污染的器械示例:如輸液泵和呼吸機等。
在選擇消毒劑時應考慮器械在臨床使用中可能遭受到的最嚴重的污染的情況,同時消毒劑應與器械有良好的兼容性。此外注冊申請人使用的消毒劑應盡可能是醫療機構中常用的。如果某些消毒劑可能會對器械造成損害,應在說明書中予以警告。
在使用期間可能不會被病原體污染的低度危險性器械(例如血壓計袖帶、聽診器等)通常無需消毒,清潔后即可使用;如遇有污染應及時先清潔,后采用中、低效的消毒劑進行消毒。
4.再處理說明在技術上應可行且使用合法上市的設備和附件
在預期使用環境(例如,醫療機構或家庭)中,再處理說明應具有可操作性,并明確再處理過程所需的設備和附件。例如,輻照滅菌通常僅用于生產企業滅菌而非使用者滅菌,在醫療機構中蒸汽滅菌是最常見,也可見到EO、過氧化氫、臭氧以及液體化學滅菌,但較少見到干熱和化學蒸汽滅菌。
再處理說明中規定的、用于器械再處理的滅菌參數應與常用的滅菌器的經確認的滅菌參數一致。
加強循環通常包括較長的暴露時間和/或較高的溫度。通常用于對復雜器械或較大負載進行滅菌。如果再處理說明中推薦使用加強循環,則應明確經過確認的循環參數及可以用于此類加強循環的附件。
5.再處理說明應全面
全面的說明使用戶能夠準確了解如何安全有效地實施整個再處理過程。再處理說明可以有多種格式,完整的再處理說明應包含以下所有內容。如果器械不適用于某些條款,則注冊申請人在申報資料中應說明相應的不適用原因及依據。
5.1特殊附件
再處理說明應明確再處理過程中需要的附件。如果器械在再處理期間需要特殊保護(例如,使用閥門、塞子或螺旋帽以防止刺激性化學品進入),則應對其進行詳細描述。再處理說明還應確定所需的任何特殊工具、刷子(包括定制化刷子)的類型和尺寸、沖洗口連接器的尺寸規格、托盤、測試工具、滅菌器附件的尺寸和類型等。說明應足夠清晰以便用戶可以購買正確的物品,包括任何定制的附件,或明確購買渠道。
5.2預處理
根據需要,再處理說明應包括適當的器械使用現場的預處理說明。例如,宜在清潔步驟之前在器械使用現場進行快速的預處理或采取防止污物在器械表面上干固的措施,以有利于后續的清潔操作。
一般來說,再處理過程應盡可能縮短每一步驟之間的時間間隔。過長的時間間隔可能利于微生物的生長,從而增加后續處理(如清潔和消毒/滅菌)過程的難度,因為有機污染物可能會阻止消毒劑或滅菌劑的完全滲透。
5.3拆卸和重新組裝
如果器械具有可拆解的部件,則再處理說明應包括每一步拆卸和重新組裝的說明,以及進行拆卸所需的工具,必要時可以使用圖示、照片、視頻等。此外,還應該規定對器械進行拆卸及組裝的工作區域(如器械使用現場,或特定的清潔區)。
拆卸和重新組裝說明應清晰明確且具有強針對性,能體現經確認的操作過程。“如適用,則進行拆卸”之類的模糊表述會將決策權留給用戶,應避免使用這類的表述。如果要求在清潔之前必須拆卸器械,則應確認在需要時能夠正確重新組裝。為了保證重新組裝后的器械可以正常使用,再處理說明應提供用戶能夠確認器械已正確重新組裝的方法。再處理說明還應規定拆解后的器械應在滅菌之前還是之后進行重新組裝。此外,在器械完全組裝的狀態下可能無法評估某些部件的磨損情況,拆卸和重新組裝說明應告知用戶在拆解狀態下如何目視檢查這些部件。
5.4清潔方法
再處理說明中應提供詳細的、經過確認的清潔方法,該方法可以是手動的、自動的(例如,清洗消毒設備、超聲波清洗器)或者兩者結合。需要注意的是,某些醫療器械可能會應用在并未配備自動清潔設備的醫療機構中,這種情況下需要提供經確認的手動清潔方法。應明確每一種推薦方法所應用的參數等信息。
對于手動清潔,再處理說明應指明每個步驟的持續時間、溫度、水質和其他必要條件。基于產品的設計和確認活動所需,再處理說明中可要求對器械進行重復啟動、彎曲等操作。類似地,對于自動清潔,再處理說明應指明所有處理條件。再處理說明應給出具體的設備設置,如時間、溫度和最大負載等。
無論清潔方法為手動、自動還是兩者結合,再處理說明都應包含每個清潔、漂洗、干燥等步驟的全面的操作說明(包括圖片和/或圖表),以便用戶可以準確地遵循這些步驟去執行。清潔劑和自動清潔設備的推薦使用說明應與清潔劑和清潔設備制造商的說明保持一致。
由于醫務人員的日常活動,某些器械可能存在被患者污染物污染的風險,此類器械再處理說明中應包含醫療器械表面的清潔說明,即使僅進行簡單的表面清潔,再處理說明都應該明確清潔方法、針對特定部位或材料的注意事項、拆解要求以及后續的處理步驟。需要注意的是,某些器械產品在臨床使用時內部組件未被污染,但進行表面清潔時,由于與醫用清洗劑或消毒劑的接觸可能導致內部組件的受損,表面清潔說明中應說明如何充分清潔器械,并避免器械內部受到損害。
5.5醫用清洗劑
再處理說明中推薦的醫用清洗劑應是與器械相容性良好且經過確認能夠達到預期的清洗效果。再處理說明中應提供制備和使用這些清洗劑的說明(例如,每千克水混合10克清洗劑),或者參考清洗劑的使用說明(例如,根據清洗劑制造商的要求)。用于特定醫療器械的說明應符合相應的清洗劑制造商的產品使用說明。
需要注意的是,某些產品(例如一些季銨化合物和醇)可用于清潔(去除污物)和消毒(微生物滅活)。而其他產品可能只能完成單一清潔或消毒作用。如果旨在進行清潔和消毒,再處理說明應明確清潔和消毒之間的區別以及每個步驟的使用方法。
5.6漂洗
再處理說明中應包含用以去除再處理過程中使用的化學殘留物的漂洗說明,清潔后、使用液體高水平消毒劑和液體化學殺菌劑后應進行漂洗。漂洗可能是手動或自動。漂洗說明應提供漂洗水的類型和質量、漂洗持續時間(或漂洗次數、體積和重復次數)以及溫度等參數。可以參考清洗劑的使用說明來制定漂洗說明。
經確認的漂洗說明應確保殘留的清潔劑和液體化學消毒劑/殺菌劑不會干擾后續的再處理以及降低到無毒性的水平。此外,對于某些器械,應注意終末漂洗水應足以去除細菌內毒素(請注意,自來水可能含有細菌內毒素)。注冊申請人可以參考當前版本的AAMI TIR34 “Water for the reprocessing of medical devices”或者WS 310.1 “醫院消毒供應中心 第1部分:管理規范”,了解有關終末漂洗水的更多信息,并根據器械的適用范圍確定終末漂洗的最佳水質。
此外,不建議將生理鹽水溶液作為終末漂洗用水,因為生理鹽水溶液可能會干擾后續消毒或滅菌步驟,也可能導致某些器械的腐蝕和無機殘留物的積聚。
5.7潤滑劑
使用潤滑劑可以減少器械磨損和腐蝕,是延長某些醫療器械使用壽命的有效方法。如果適用,再處理說明應給出推薦的潤滑劑名稱或潤滑劑種類(如水溶性的潤滑劑),潤滑劑應與醫療器械、適用范圍以及后續處理步驟(如滅菌)具有良好的相容性。此外,再處理說明還應參考潤滑劑的使用說明。
如果再處理說明明確要求使用潤滑劑,則應在使用潤滑劑的條件下確認器械再處理方法。
應謹慎使用油基和硅酮潤滑劑,因為其可以覆蓋和保護表面微生物,并降低某些滅菌方法(如蒸汽和EO)的有效性,甚至可以為微生物生長提供營養。
5.8目視檢查
清潔說明應提供目視檢查說明,可能需要使用放大設備以及照明設備。說明應要求如果在清潔步驟完成時觀察到器械未完全清潔,則應重復之前的清潔步驟或者安全地廢棄該器械。此外,目視檢查說明應明確與器械性能相關的驗收標準(例如,腐蝕、變色、點蝕、密封破裂等),以及正確處置故障器械的說明(如停止使用、廢棄等)。
5.9消毒或滅菌方法
對于要進行消毒或滅菌的可重復使用器械,再處理說明應規定至少一種經過確認的殺滅微生物方法(消毒或滅菌)。殺滅微生物的方法的選擇主要取決于再處理產品的類型,請參考本指導原則五(五)3的要求。
滅菌設備的規格和滅菌周期的參數因滅菌設備制造商而異,再處理說明應識別滅菌方法和類型,并且列明確認過的循環參數。傳統的滅菌方法(如蒸汽和EO)已在行業中標準化,從而可以通過重要循環參數來確定滅菌周期。也可使用重要循環參數確定這些滅菌過程所需附件(滅菌容器、滅菌包裝等)。
使用較新的低溫化學滅菌方法(例如,過氧化氫、臭氧等)滅菌時的滅菌參數也因滅菌設備制造商而異。因此,對于這些滅菌過程,應在再處理說明中明確滅菌設備的制造商、型號和滅菌循環標識(名稱或滅菌參數)。適用于這些滅菌過程的附件應由附件的制造商明確其適用的滅菌設備的制造商、型號、滅菌循環名稱和/或循環參數。
對于任何滅菌方法,完整的滅菌參數應包括所有關鍵循環參數和其他相關信息。例如:
濕熱/蒸汽:循環類型(脈動預真空或下排氣)、暴露時間、溫度、干燥時間
EO:EO濃度(和氣體成分)、暴露時間、相對濕度、溫度、通風時間
H2O2和O3:設備制造商、型號、每個型號的特定循環參數(按名稱或特定循環參數標識)
干熱:暴露時間、溫度
再處理說明中應盡可能最大限度的提供產品設計、包裝以及裝載特性相關的規格信息。例如:
重量:應提供裝載托盤的最大承重信息;
材料:應警示與滅菌過程不兼容的材料(如纖維素與H2O2不兼容);
設計:被滅菌器械的尺寸或特性(如管腔規格、電動的牙科手機)應與滅菌器或滅菌循環兼容;
裝載:應描述裝載的情況,例如,是在空載還是在滿載(最差情況)下做的確認;
干燥:應告知用戶在為滅菌而進行包裝時,器械應是干燥的;
無菌的保持:應提供可以容許滅菌劑穿透以及保持器械無菌的包裝信息,詳見五(三)1.4。
5.10減少滅菌劑殘留
針對某些可能在器械上殘留滅菌劑的其他滅菌過程(如EO、過氧化氫等),應提供減少滅菌劑殘留(例如通風)的再處理說明。
例如,對于使用EO進行滅菌的器械,說明中應給出建議的通風時間,以將EO殘留減少到可接受的水平。有關EO通風的建議,可以參考YY/T 1544 “環氧乙烷滅菌安全性和有效性的基礎保障要求”、WS/T 367 “醫療機構消毒技術規范”和AAMI ST41 “Ethylene Oxide Sterilization in Health Care Facilities: Safety and Effectiveness”等內容。(有關可接受EO殘留水平的更多內容可以參考GB/T 16886.7及GB 18279系列等相關標準)。
5.11干燥
在高水平消毒或液體化學滅菌后,器械有可能有液體附著,干燥步驟可以減少或消除未包裝器械的再污染。再處理說明中應給出推薦的干燥方法,這樣可以降低被微生物污染的風險。再處理說明中還應建議經過確認的最短干燥時間。再處理后駐留在產品上的水分可能會損害包裝材料的無菌屏障屬性和密封的有效性,從而損害包裝的完整性和密封性。
中途干燥(即,清潔后的干燥)是另一個需要重點關注的因素,因為在器械上殘留的水分可能會干擾后續再處理過程。如果后續再處理過程在清潔后的一段時間才進行,那么再處理說明中應該給出建議的有效的中途干燥方法,以滿足后續再處理的需要。
5.12重復使用壽命
再處理說明應基于驗證結果告知用戶產品可使用的次數;或向用戶提供用于確定器械是否已經超過其使用壽命的方法。在后一種情況下,應給出確定該器械仍然滿足其性能指標(適用范圍)的方法;同時,若其不能滿足,也應給出適當的處理方法。例如:
說明器械設計特性,如內置的自動預檢功能;
說明重新使用之前應通過的測試內容;
說明目視檢查的驗收標準(例如不可接受的惡化,如腐蝕、變色、點蝕、密封破裂)。
無論選擇哪種方法,再處理說明應針對如何評估復雜器械中難以直接觀察到的區域的老化程度給出建議,特別是管腔內的老化(例如可采用泄漏試驗)。
重復使用壽命應綜合考慮產品可以耐受的再處理及重復使用的次數來確定,并在再處理說明中給出。如果再處理過程對器械的重復使用壽命起到決定性作用,則再處理說明中應給出產品可耐受再處理循環的次數,并應提醒用戶該有限次重復使用循環取決于是否完全遵守該器械的使用說明。
5.13其他建議
最初以非無菌形式提供給用戶,并且要求用戶在首次使用前進行滅菌的產品,需要在每個產品的獨立包裝上(而非僅僅在運輸包裝上)對其非無菌特性進行顯著地標識以確保在使用前完成了滅菌。在需要進行再處理時,應提供有關再處理過程的所有警告及注意事項。這些可能與用戶再處理的有效性及產品性能或使用者安全有關。例如,一些器械可能具有未密封縫隙,消毒過程中,過量的液體消毒劑可能通過縫隙進入器械內部并損壞器械。在這種情況下,說明應警告用戶這種潛在的危險,并提供具體的使用說明來防止這種危害。例如避免使用過量的液體消毒劑等。宜告知用戶發生何種損壞可能會影響到再處理過程。
5.14患者或非專業人士使用
旨在由患者或非專業人士(例如,家庭成員或其他人)使用的器械,再處理說明應易于理解并且可在相應的使用環境中(如家庭)進行再處理。執行再處理所用的各種設備及附件也應在預期使用環境中易于獲得。
5.15參考內容
除本指導原則中擬定的建議外,可重復使用器械再處理說明還可向用戶提供額外的參考標準或規范,但不得代替已確認的再處理說明。再處理的要求以注冊申請人提供的說明書指示信息為準。
只要所參考的標準與規范與可重復使用器械的再處理說明不沖突,就可用于器械的再處理。例如,《軟式內鏡清洗消毒技術規范》和《口腔器械消毒滅菌技術操作規范》等可以供相應醫療器械的再處理作為參考。
6.再處理說明應易于理解
再處理說明應清晰、易讀(如:字體大小應合理)、并遵循一定的邏輯順序,即應順次從初始再處理步驟至最終步驟,例如預處理、拆卸、清潔、漂洗、干燥、重新組裝、消毒或滅菌、消毒或液體化學滅菌后的終末漂洗以及后處理(干燥、解析等)。再處理說明應盡可能用簡單易懂的語言,并且詳盡地對每步操作進行準確的解釋。圖示、圖解有助于用戶理解和執行再處理說明,同時應附有相應的說明文字以確保用戶能夠理解并遵守。
六、參考文獻
[1]FDA. Reprocessing Medical Devices in Health Care Settings: Validation Methods and Labeling Guidance for Industry and Food and Drug Administration Staff[Z].USA : FDA,2017.
[2]ISO 17664-1:2021,Processing of health care products — Information to be provided by the medical device manufacturer for the processing of medical devices — Part 1: Critical and semi-critical medical devices [S].
[3]ISO 17664-2:2021,Processing of health care products — Information to be provided by the medical device manufacturer for the processing of medical devices — Part 2: Non-critical medical devices[S].
[4]YY/T 0802-2020,醫療器械的滅菌 制造商提供的處理可重復滅菌醫療器械的信息[S].
[5]GB 15982-2012,醫院消毒衛生標準[S].
[6]GB/T 15981-2021,消毒器械滅菌效果評價方法
[7]WS/T 367-2012,醫療機構消毒技術規范[S].
[8]WS 507-2016,軟式內鏡清洗消毒技術規范[S].
[9]WS 310.1-2016,醫院消毒供應中心 第1部分:管理規范[S].
[10]WS 310.2-2016,醫院消毒供應中心 第2部分:清洗消毒及滅菌技術操作規范[S].
[11]WS 310.3-2016,醫院消毒供應中心 第3部分:清洗消毒及滅菌效果監測標準[S].
[12]YY 0734.1-2018,清洗消毒器 第1部分:通用要求和試驗[S].
[13]AAMI TIR30:2011(R2016),A Compendium Of Processes, Materials, Test Methods, And Acceptance Criteria For Cleaning Reusable Medical Devices[S].
[14]AAMI TIR12:2020 Designing, Testing, And Labelling Medical Devices Intended For Processing By Health Care Facilities: A Guide For Device Manufacturers[S].
[15]GB/T 16886.7-2015,醫療器械生物學評價 第7部分:環氧乙烷滅菌殘留量[S].
[16]國家藥品監督管理局.關于公布醫療器械注冊申報資料要求和批準證明文件格式的公告:2021年第121號公告[Z].
【附件1】
名詞解釋
生物指示物:將適當載體染以一定量的特定微生物,用于指示消毒或滅菌效果的制品。
清潔:去除物品上的污物和污染物,使之達到可進一步處理或適用范圍所需的程度。
消毒劑:用于殺滅傳播媒介上的致病微生物使其達消毒或滅菌要求的制劑。消毒劑破壞的是公認程度最高的致病微生物,但不一定涵蓋所有微生物形式,如細菌芽孢。
消毒:通過物理或化學的方法清除或殺滅傳播媒介上致病微生物,使其達到無害化的處理。消毒過程不能確保與滅菌過程相關的相同安全幅度。根據消毒劑的性質,消毒過程的致死率可能有所不同,從而使消毒劑的性質分為以下子類別:
高水平消毒:在低于滅菌條件下使用滅菌劑的致死過程。除了大量的細菌芽孢,該過程可殺死所有形式的微生物。
中水平消毒:使用可殺死病毒、分枝桿菌、真菌和細菌繁殖體但無法殺死細菌芽孢的藥劑的致死過程。
低水平消毒:僅能殺滅細菌繁殖體,一些真菌和親脂性病毒的致死過程。
滅菌劑:能夠殺滅一切微生物,達到滅菌要求的制劑。
過程確認:通過客觀證據確定過程可始終產生滿足其預定規格的結果或產品。
再處理:為滿足后續單次使用要求,用于處理新的或使用過的醫療器械經確認的過程。這些過程包括清潔、消毒和滅菌。
可重復使用醫療器械:用于在相同或不同患者上重復使用的器械,其中,在使用間應進行適當的清潔和其他再處理
一次性使用器械:僅供單次使用,或在單個手術期間用于單個患者的器械。
孢子:微生物(通常是細菌或真菌)的休眠狀態,其表現為生物合成活性、降低呼吸活性等的缺乏,并具有對熱、輻射、干燥和各種化學試劑的抗性。
無菌:無存活微生物。
無菌保證水平(SAL):滅菌后單位產品上存在單個活微生物的概率。通常表示為10-n。
滅菌:使產品不含有活性微生物的經確認的過程。
注意:在滅菌過程中,微生物滅活的規律用指數函數表示,因此,任何單件產品上的微生物存活率可以用概率來表示。雖概率可以降低到很低,但不可能降為零。
滅菌包裝:滅菌包裝(滅菌袋或滅菌用附件)用于封裝醫療服務人員打算進行滅菌的醫療器械。目的為允許對封裝的醫療器械進行滅菌,并且在使用前維持封裝器械的無菌性。
【附件2】
可重復使用醫療器械再處理概述
下圖所示為一般再處理步驟的過程概述,對可重復使用醫療器械進行適當的處理和再處理以供下一次使用。
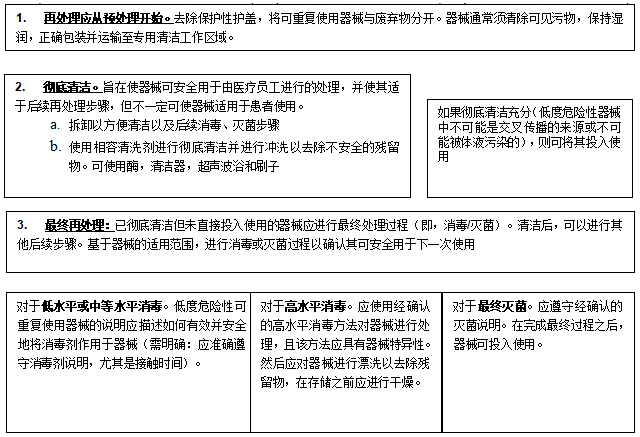
圖3過程概述
【附件3】
表1 部分難以進行再處理的醫療器械產品結構設計特征
【附件4】
表2 高度關注的產品目錄
#相關推薦#
