定制式醫療器械作為個性化醫療器械,用于診斷治療罕見特殊病損且使用人數極少的特點,難以通過現行的注冊管理模式進行注冊,為了滿足臨床需求,其監管方式也跟常規醫療器械不同,采用上市前備案管理,由定制式醫療器械生產企業及醫療機構共同作為備案人在生產或使用定制式醫療器械前向所在地藥監部門備案。
一、定制式醫療器械定義及特點
定制式醫療器械是指為滿足指定患者的罕見特殊病損情況,在我國已上市產品難以滿足臨床需求的情況下,由醫療器械生產企業基于醫療機構特殊臨床需求而設計和生產,用于指定患者的、預期能提高診療效果的個性化醫療器械。
1. 用于診斷治療罕見特殊病損情況,預期使用人數極少,沒有足夠的人群樣本開展臨床試驗;
2. 我國已上市產品難以滿足臨床需求;
3. 由臨床醫生提出,為滿足特殊臨床需求而設計生產;
4. 用于某一特定患者,預期能提高診療效果。
二、定制式醫療器械備案單元劃分
主要原材料、生產工藝、技術原理、結構組成、關鍵性能指標及適用范圍基本相同的定制式醫療器械構成一個備案單元。對于配合使用、以完成同一手術/醫療目的的定制式醫療器械組合可以作為同一備案單元。
三、定制式醫療器械生產企業備案要求
1. 有定制式醫療器械研制、生產所需的專業技術人員;
2. 具備定制式醫療器械研制能力和研究基礎;
3. 有相同類型的依據標準規格批量生產的醫療器械注冊證及相應生產許可證(境外生產企業應當持有注冊地或者生產地址所在國家或者地區醫療器械主管部門出具的企業資格證明文件);
4. 有相同類型的依據標準規格批量生產的醫療器械的生產能力和生產經驗,并符合相應的質量管理體系。
四、醫療器械使用定制式醫療器械的條件
1. 三級綜合或者三級專科醫院,具有與使用的定制式醫療器械相適應的診療項目;
2. 有在醫療機構注冊的、能夠使用定制式醫療器械的主診醫師;
3. 具備使用同類已上市產品的經驗,已開展同種疾病研究和治療,臨床專業水平國內先進;
4. 具備較高的醫療器械管理水平,已建立完善的醫療器械使用質量管理體系,具備醫療器械使用評價和醫療器械不良事件監測能力。
五、定制式醫療器械備案流程
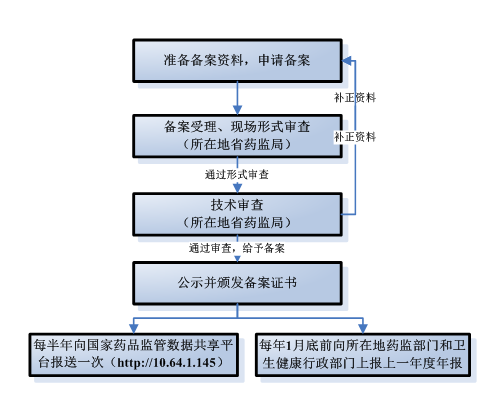
六、定制式醫療器械備案資料要求
No. 備案資料 資料要求 1 定制式醫療器械備案表 2 生產使用定制式醫療器械必要性的說明 包括患者病損特殊性、定制式醫療器械特點、預期提高療效等說明 3 定制式醫療器械研制相關資料 包括制作訂單、產品設計要求,產品結構組成、工作原理、作用機理、主要原材料,產品驗收標準,以及相關設計制造驗證確認等資料 4 產品風險分析資料 按照YY/T 0316《醫療器械 風險管理對醫療器械的應用》的有關要求編制 5 生產制造信息 無源醫療器械應當明確產品生產加工工藝,注明關鍵工藝和特殊工藝。有源醫療器械應當提供產品生產工藝過程的描述性資料,可采用流程圖的形式,是生產過程的概述。體外診斷試劑應當概述主要生產工藝,包括:固相載體、顯色系統等的描述及確定依據,反應體系包括樣本采集及處理、樣本要求、樣本用量、試劑用量、反應條件、校準方法(如果需要)、質控方法等 6 臨床使用方案 應包含患者救治預案 7 倫理委員會意見 8 生產企業與醫療機構的協議 應當明確各方責任和義務 9 證明性文件及材料 境內生產企業:營業執照、組織機構代碼證、同類醫療器械注冊證及生產許可證、專業技術人員履歷 境外生產企業:境外生產企業證明、同類醫療器械注冊證、專業技術人員履歷、境內代理人委托書及代理人承諾書、營業執照等 醫療機構:醫療機構執業資格許可證、醫療機構級證明文件;醫療器械質量管理部門概況、人員、制度及SOP等;符合性聲明。
七、定制式醫療器械備案不適用情況
- 定制式醫療器械不得委托生產
- 定制式醫療器械臨床使用病例數及前期研究達到上市前審批要求時
- 非訂單醫療機構或者非指定患者不得使用
- 未經備案或者備案已經取消的定制式醫療器械,生產企業不得生產,醫療機構不得使用
- 定制式醫療器械生產企業不具備相同類型的依據標準規格批量生產的醫療器械產品的有效注冊證或者生產許可證時,備案自動失效
- 同類產品已經獲得批準注冊的,備案自動失效
- 已有批準上市可替代醫療器械的,取消定制式醫療器械備案
- 提供虛假資料獲得備案的,取消備案并通報
- 含有藥物成份或者細胞、組織等生物活性成份的定制式醫療器械不適用
- 軍隊醫療器械機構使用定制式醫療器械的情況不適用
