新《醫療器械監督管理條例》(國務院650號令)已于2014年6月1日正式實施,其配套的《醫療器械注冊管理辦法》(4號令),也已于2014年10月1日正式實施,新實施的法規明確了企業在注冊前需要按照質量體系的要求研制樣品,進行必要的基礎研究,并在注冊時向主管藥監局提交相應的研究資料。CFDA在2015年5月27日發布了 《國家食品藥品監督管理總局關于發布藥品、醫療器械產品注冊收費標準的公告(2015年第53號)》,該通告明確了產品注冊不被許可的情況,注冊費用將不予退回。而目前不被許可的大部分企業產品在研發階段基礎研究不夠充分,不能充分證明產品的安全有效性。
因此,在研發階段注冊資料準備的是否充分將直接決定企業的注冊成本、產品能否上市或注冊的周期。
瑞旭技術建議企業在研發階段應由相關技術人員介入,避免企業在產品設計開發階段由于某方面的缺失導致基礎研究不充分。
以下是企業在研發階段建議參與的人員及相關職責| 設計開發階段需要介入的人員 | 職責 |
| 醫療器械法規專員 | 收集法規,標準,質量體系的培訓及宣貫 |
| 醫療器械開發技術人員 | 產品設計,試產,驗證,檢測,技術及工藝輸出 |
| 醫療器械臨床人員 | 臨床使用要求,風險點,臨床試驗指導 |
| 醫療器械市場專員 | 市場調研,臨床需要 |
| 設計專員 | 協助開發技術人員外形設計及包裝標簽設計 |
瑞旭技術根據產品研制及申報過程,建議企業可以參照下圖進行研制時注冊資料準備。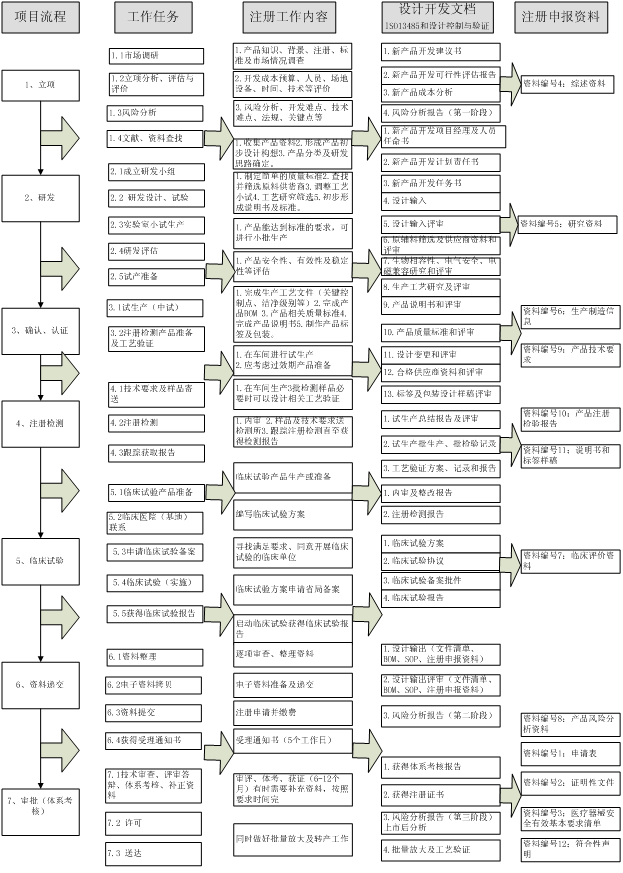
根據以上產品的研發及申報流程,瑞旭技術建議企業在整個研發過程均應由注冊人員參與,避免產品在已經定型后,不符合相關法規的要求而導致時間,財力及人力的浪費。
