一、適用范圍
本指南適用于第三類高風險醫療器械臨床試驗審批的申請和辦理
二、項目信息
(一)項目名稱:第三類高風險醫療器械臨床試驗審批
(二)子項名稱:無
(三)事項審查類型:前審后批
(四)項目編碼:30018
三、辦理依據
《醫療器械監督管理條例》(國務院令第650號)第十九條:第三類醫療器械進行臨床試驗對人體具有較高風險的,應當經國務院食品藥品監督管理部門批準。臨床試驗對人體具有較高風險的第三類醫療器械目錄由國務院食品藥品監督管理部門制定、調整并公布。
《國家食品藥品監督管理總局關于調整部分醫療器械行政審批事項審批程序的決定》(局令第32號):將下列由國家食品藥品監督管理總局作出的醫療器械行政審批決定,調整為由國家食品藥品監督管理總局醫療器械技術審評中心以國家食品藥品監督管理總局名義作出:
一、第三類高風險醫療器械臨床試驗審批決定;
二、國產第三類醫療器械和進口醫療器械許可事項變更審批決定;
三、國產第三類醫療器械和進口醫療器械延續注冊審批決定。
其他醫療器械注冊申請的審批決定,按現程序,由國家食品藥品監督管理總局作出。
四、受理機構
國家藥品監督管理局醫療器械技術審評中心
五、決定機構
國家藥品監督管理局醫療器械技術審評中心以國家藥品監督管理局名義作出
六、審批數量
無數量限制
七、申請條件
境內申請人應為境內依法進行登記的企業。境外申請人應為境外生產企業,且該醫療器械已在注冊申請人注冊地或者生產地址所在國家(地區)已獲準上市銷售。申請的醫療器械應列入《關于發布需進行臨床試驗審批的第三類醫療器械目錄的通告》(2014年第14號)的目錄中。
八、禁止性要求
(一)申請人對擬上市銷售醫療器械的安全性、有效性進行的研究及其結果無法證明產品安全、有效的;
(二)注冊申報資料虛假的;
(三)注冊申報資料內容混亂、矛盾的;
(四)注冊申報資料的內容與申報項目明顯不符的;
(五)不予注冊的其他情形。
九、申請材料
(一)申請材料清單
1.申請表
2.證明性文件
(1)境內申請人應當提交:企業營業執照副本復印件;組織機構代碼證復印件。
(2)境外申請人應當提交:境外申請人注冊地或生產地址所在國家(地區)醫療器械主管部門出具的允許產品上市銷售的證明文件和合法資格證明文件;境外申請人在中國境內指定代理人的委托書、代理人承諾書及營業執照副本復印件或者機構登記證明復印件。
3.試驗產品描述
應當包括試驗用醫療器械的設計原理、工作原理、產品特征、結構組成及圖示、制造材料、包裝材料、型號規格及其劃分依據、主要生產工藝、交付狀態、作用機理、適用范圍等內容。
4.臨床前研究資料
一般應當包括:
(1)申請人對試驗用醫療器械進行的臨床前研究資料。例如,實驗室研究、動物試驗等。
(2)與評價試驗用醫療器械安全性和有效性相關的已發表文獻及評論性綜述。
(3)國內外同類產品研發、上市及臨床應用情況及試驗用醫療器械與國內外已上市同類產品在工作原理、結構組成、制造材料、技術參數及適用范圍等方面的異同比較資料。
(4)與試驗用醫療器械相關的不良事件信息。
(5)臨床試驗受益與風險對比分析報告。
(6)其他要求提交的研究資料。
5.產品技術要求
6.醫療器械檢驗機構出具的注冊檢驗報告和預評價意見
7.說明書及標簽樣稿
8.臨床試驗方案
臨床試驗方案應當符合原國家食品藥品監督管理總局發布的《醫療器械臨床試驗質量管理規范》相關要求,并提交證明臨床試驗方案科學合理性的分析資料。
9.倫理委員會同意臨床試驗開展的書面意見
應當提交全部臨床試驗機構的倫理委員會同意臨床試驗開展的書面意見。
10.符合性聲明
(1)申請人聲明本產品符合《醫療器械注冊管理辦法》和相關法規的要求。
(2)申請人聲明所提交資料的真實性。
(二)申請材料提交
申請人可通過窗口報送、郵寄等方式提交材料。
十、申請接收
(一)接收方式
1.窗口接收;
2.郵寄接收。
接收部門:國家藥品監督管理局行政受理服務大廳
接收地址:北京市西城區宣武門西大街28號大成廣場3門一層
郵政編碼:100053
聯系電話:010-88331866
電子郵箱:slzx@cfda.gov.cn
(二)對外辦公時間
上午:9:00—11:30
下午:13:00—16:00
十一、辦理基本流程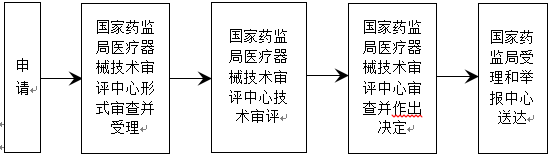
十二、辦理方式
1.受理
申請人按照本《指南》第八條要求,向國家藥品監督管理局行政受理服務大廳提出申請,受理人員按照《關于公布醫療器械注冊申報資料要求和批準證明文件格式的公告》(2014年第43號)的要求對申報資料進行形式審查。
申請事項屬于本部門職權范圍,申報資料齊全、符合形式審查要求的,予以受理;申報資料存在可以當場更正的錯誤的,允許申請人當場更正;申報資料不齊全或者不符合形式審查要求的,在5個工作日內一次告知申請人需要補正的全部內容,逾期不告知的,自收到申報資料之日起即為受理;申請事項不屬于本部門職權范圍的,即時告知申請人不予受理。
2.審查
受理人員自受理之日起3個工作日內將申報資料轉交技術審評機構。
技術審評機構應當在40個工作日內完成技術審評工作。
3.許可決定
國家藥品監督管理局醫療器械技術審評中心應當在技術審評結束后20個工作日內作出決定。準予開展臨床試驗的,發給醫療器械臨床試驗批件;不予批準的,應當書面說明理由。
4.送達
自作出審批決定之日起10個工作日內,國家藥監局行政事項受理服務和投訴舉報中心將行政許可決定送達申請人。
十三、審批時限
1.受理:5個工作日;
2.行政許可決定:20個工作日(不含技術審評和申請人補充資料及補充資料審評所需的時間)。20個工作日內不能做出決定的,經局領導批準,可延長10個工作日。
十四、審批收費依據及標準
(一)收費環節:受理
(二)收費項目:第三類高風險醫療器械臨床試驗審批
(三)收費依據:國家發展改革委《關于重新發布中央管理的食品藥品監督管理部門行政事業性收費項目的通知》(財稅〔2015〕2號)和《關于印發〈藥品、醫療器械產品注冊收費標準管理辦法〉的通知》(發改價格〔2015〕1006號),《國家食品藥品監督管理總局關于發布藥品、醫療器械產品注冊收費標準的公告》(2015年第53號)。
(四)收費標準:4.32萬元。
十五、審批結果
國家藥品監督管理局
醫療器械臨床試驗批件
(格式)
批件號:
申請人 | |
申請人住所 | |
試驗用醫療器械名稱 | |
試驗用醫療器械 型號、規格 | |
試驗用醫療器械 結構及組成 | |
審批意見 | |
主送 | |
抄送 | |
備注 |
審批部門: 批準日期:年 月 日
(審批部門蓋章)
十六、結果送達
自作出審批決定之日起10個工作日內,國家藥監局行政事項受理服務和投訴舉報中心將行政許可決定送達申請人。
十七、申請人權利和義務
(一)依據《中華人民共和國行政許可法》,申請人依法享有以下權利:
1.依法取得行政許可的平等權利;
2.對行政機關實施行政許可,享有陳述權、申辯權;
3.依法申請行政復議或者提起行政訴訟;
4.合法權益因行政機關違法實施行政許可受到損害的,有權依法要求賠償。
(二)依據《醫療器械注冊管理辦法》第三十六條,受理注冊申請的藥品監督管理部門對不予注冊的,應當書面說明理由,并同時告知申請人享有申請復審和依法申請行政復議或者提起行政訴訟的權利。
(三)依據《中華人民共和國行政許可法》、《醫療器械注冊管理辦法》等,申請人應履行以下義務:
1.對申請材料實質內容的真實性負責;
2.依法開展取得行政許可的活動;
3.如實向負責監督檢查的行政機關提供有關情況和材料。
十八、咨詢途徑
(一)窗口咨詢;
(二)電話咨詢;
(三)電子郵件咨詢;
(四)信函咨詢。
咨詢部門:國家藥品監督管理局行政受理服務大廳
通訊地址:北京市西城區宣武門西大街28號大成廣場3門一層
郵政編碼:100053
聯系電話:010-88331776
電子郵箱:slzx@cfda.gov.cn
十九、監督和投訴渠道
部門名稱:國家藥品監督管理局行政事項受理服務和投訴舉報中心
地址:北京市海淀區蓮花池東路39號西金大廈七層
郵編:100036
電話:12331
二十、辦公地址和時間
(一)辦公地址:北京市西城區宣武門西大街28號大成廣場3門一層
(二)對外辦公時間
上午:9:00—11:30
下午:13:00—16:00(周三、周五下午不對外受理)
(三)乘車路線
地鐵:地鐵2號線長椿街站D出口,往西799米即到。或地鐵7號線廣安門內站A出口,往北893米即到。
公交:乘坐56路,78路,395路,423路在槐柏樹街西口下車,步行222米即到。乘坐42路,46路,49路,691路在天寧寺橋東下車,步行252米即到。乘坐26路,390路,395路,423路,456路,662路,691路在西便門下車,步行263米即到。
二十一、公開查詢
可通過網站http://samr.cfda.gov.cn/WS01/CL0135/查詢審批狀態和結果。
二十二、實施日期
自2018年10月1日起施行。
