【高分子耗材類產品臨床試驗及評價重點問題分析】
常見高分子耗材醫療器械- 輸注類產品:如靜脈輸液針、輸液器、注射器等。
- 體外循環類產品:膜式氧合器、人工心肺機體外循環管道等。
- 血液透析類產品如:血液透析器、血液透析用管路等。
- 其他類產品。
- 聚氯乙烯(PVC):GB15593-1995;
- 丙烯腈-苯乙烯-丁二烯共聚物(ABS):GB/T 12672-2009;
- 聚乙烯(PE):YY/T0014-2008;
- 聚丙烯(PP):YY/T0242-2007;
- 聚碳酸酯(PC):YY/T0806-2010;等。
1.相關法規、規章、規范性文件
1.1 《醫療器械臨床評價技術指導原則》(總局通告2015年14號);
1.2 《醫療器械臨床試驗質量管理規范》(總局令第25號)
1.3 《醫療器械監督管理條例》(國務院令第650號);
1.4 《醫療器械注冊管理辦法》(總局令第4號);
1.5 《免于進行臨床試驗的第三類醫療器械目錄》(總局通告2014年第13號);
1.6 《關于執行醫療器械和體外診斷試劑注冊管理辦法有關問題的通知》(食藥監械管〔2015〕247號);
1.7 各類醫療器械注冊申報指導原則。
1.2 《醫療器械臨床試驗質量管理規范》(總局令第25號)
1.3 《醫療器械監督管理條例》(國務院令第650號);
1.4 《醫療器械注冊管理辦法》(總局令第4號);
1.5 《免于進行臨床試驗的第三類醫療器械目錄》(總局通告2014年第13號);
1.6 《關于執行醫療器械和體外診斷試劑注冊管理辦法有關問題的通知》(食藥監械管〔2015〕247號);
1.7 各類醫療器械注冊申報指導原則。
2.臨床評價的定義及基本原則
醫療器械臨床評價是指申請人或者備案人通過臨床文獻資料、臨床經驗數據、臨床試驗等信息對產品是否滿足使用要求或者適用范圍進行確認的過程。(《注冊管理辦法》第二十條 )。3.臨床評價三條路徑
3.1 列入《免于進行臨床試驗的醫療器械目錄》產品的臨床評價要求3.2 通過同品種醫療器械臨床試驗或臨床使用獲得的數據進行分析評價要求
3.3 臨床試驗相關要求
3.1免于臨床試驗器械目錄產品的
臨床評價
對于列入《免于進行臨床試驗的醫療器械目錄》(以下簡稱《目錄》)產品,注冊申請人需提交申報產品相關信息,與《目錄》所述內容的對比資料和申報產品與已獲準境內注冊的《目錄》中醫療器械的對比說明。
重點問題
①提供申報產品相關信息,如產品名稱、結構組成、適用范圍等信息,注意應包括目錄中所提及內容。產品名稱應與目錄中一致,避免使用容易誤解的名稱。
②對于對比表中規定項目,不能僅有簡單的對比描述,要提供相應的技術支持文件。
如提供產品結構示意圖,注明各組件名稱和原材料信息。②對于對比表中規定項目,不能僅有簡單的對比描述,要提供相應的技術支持文件。
如產品制造材料,應提供原材料符合標準的文件等。
注明滅菌方式。
3.2 通過同品種醫療器械臨床試驗或臨床使用獲得的數據進行分析評價要求
申報產品與同品種醫療器械的對比項目(無源醫療器械)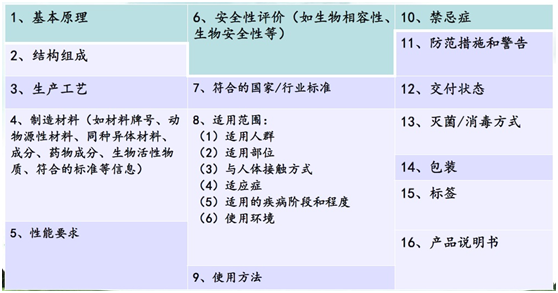
臨床評價重點問題
- 基本原理:建議與同品種比對醫療器械相同。
- 結構組成:建議與同品種比對醫療器械相同,不同的結構可能會帶來使用性能的變化。
- 制造材料:建議與同品種比對醫療器械相同。如使用新材料,將會影響化學性能、生物性能,以及臨床使用的安全性。
- 性能要求:建議與同品種比對醫療器械相同,新的使用性能可能會影響產品的臨床有效性和安全性。
- 適用范圍:建議與同品種比對醫療器械相同。
- 符合的國家/行業標準:應符合強制性國家/行業標準。
- 滅菌方式:建議與同品種比對醫療器械相同。
醫療器械臨床試驗,是指在經資質認定的醫療器械臨床試驗機構中,對擬申請注冊的醫療器械在正常使用條件下的安全性和有效性進行確認或者驗證的過程。試驗用醫療器械,是指臨床試驗中對其安全性、有效性進行確認或者驗證的擬申請注冊的醫療器械。
臨床試驗常見重點問題
①開展臨床試驗時,應盡量遵循已有注冊技術指導原則進行。采用指導原則中規定的病例入選和剔除標準、安全性觀察項目、有效性觀察項目等。
②臨床試驗方案應該明確統計檢驗的類型、判定療效有臨床意義的界值(目標值/非劣效界值)等,界值的確定應有依據。臨床試驗需明確臨床試驗病例數、評價指標等,各中心試驗方案應一致。
③如采用對照品比較,應具體說明臨床試驗樣品規格型號、對照品生產廠家、規格型號、醫療器械注冊證號等信息。
④臨床試驗建議選擇組件最全、完成全項目注冊檢測型號。對照品建議選擇原材料、功能等相同的已上市產品。如采用對照組比較,建議根據產品性能特點確定主要有效性指標,列明其判斷標準。根據主要有效性指標計算所需病例數量,提供病例數計算公式和所有涉及參數。明確各臨床試驗機構試驗樣本量。
⑤各臨床試驗機構研究者應當分別出具臨床試驗小結,數據分析時應考慮數據完整性,采用國內外公認的經典統計方法。采用對照組比較時,建議計算相關指標統計數值,并與預先設計的非劣效界值比較,進而得出合理的統計學結論。
⑥出具臨床試驗總的統計分析報告、臨床試驗報告等文件。臨床試驗報告應與臨床試驗方案保持一致。觀察項目包括有效性指標和安全性指標,報告所有不良事件發生的時間、原因、后果及與試驗用器械的關系等。
⑦臨床試驗的產品適用范圍與說明書一致。臨床試驗的禁忌癥建議列入說明書中。
⑧補充資料中涉及臨床試驗的文件,提交時均應有臨床機構的簽章。
②臨床試驗方案應該明確統計檢驗的類型、判定療效有臨床意義的界值(目標值/非劣效界值)等,界值的確定應有依據。臨床試驗需明確臨床試驗病例數、評價指標等,各中心試驗方案應一致。
③如采用對照品比較,應具體說明臨床試驗樣品規格型號、對照品生產廠家、規格型號、醫療器械注冊證號等信息。
④臨床試驗建議選擇組件最全、完成全項目注冊檢測型號。對照品建議選擇原材料、功能等相同的已上市產品。如采用對照組比較,建議根據產品性能特點確定主要有效性指標,列明其判斷標準。根據主要有效性指標計算所需病例數量,提供病例數計算公式和所有涉及參數。明確各臨床試驗機構試驗樣本量。
⑤各臨床試驗機構研究者應當分別出具臨床試驗小結,數據分析時應考慮數據完整性,采用國內外公認的經典統計方法。采用對照組比較時,建議計算相關指標統計數值,并與預先設計的非劣效界值比較,進而得出合理的統計學結論。
⑥出具臨床試驗總的統計分析報告、臨床試驗報告等文件。臨床試驗報告應與臨床試驗方案保持一致。觀察項目包括有效性指標和安全性指標,報告所有不良事件發生的時間、原因、后果及與試驗用器械的關系等。
⑦臨床試驗的產品適用范圍與說明書一致。臨床試驗的禁忌癥建議列入說明書中。
⑧補充資料中涉及臨床試驗的文件,提交時均應有臨床機構的簽章。
附:血液透析器臨床試驗重點問題
①如采用對照組,一般應選擇透析參數和膜材料
相似的透析器,試驗組和對照組按隨機原則分配。試驗條件、方法步驟、臨床觀察等應一致。
②選擇透析器膜面積小于1.5m2 、大于1.5m2的型號分別進行臨床試驗。
臨床觀察指標
①主要評價指標:肌酐和尿素氮清除率、β2-MG下降率(高通量透析器)。
②一般指標:血常規。
③生化指標:鉀、鈉、鈣、氯、磷、二氧化碳分壓、白蛋白、球蛋白、C-反應蛋白等。
④次要評價指標:整體透析肌酐和尿素下降率、超濾率等。
⑤生物相容性試驗:透析開始后15min白細胞、血小板下降率。
⑥生命體征:血壓、脈搏、體溫、心率;
⑦副反應:低血壓、過敏反應、發燒、毒血癥、菌血癥、敗血癥、其它事件等。
相似的透析器,試驗組和對照組按隨機原則分配。試驗條件、方法步驟、臨床觀察等應一致。
②選擇透析器膜面積小于1.5m2 、大于1.5m2的型號分別進行臨床試驗。
臨床觀察指標
①主要評價指標:肌酐和尿素氮清除率、β2-MG下降率(高通量透析器)。
②一般指標:血常規。
③生化指標:鉀、鈉、鈣、氯、磷、二氧化碳分壓、白蛋白、球蛋白、C-反應蛋白等。
④次要評價指標:整體透析肌酐和尿素下降率、超濾率等。
⑤生物相容性試驗:透析開始后15min白細胞、血小板下降率。
⑥生命體征:血壓、脈搏、體溫、心率;
⑦副反應:低血壓、過敏反應、發燒、毒血癥、菌血癥、敗血癥、其它事件等。
