為加強對進口化妝品的監管,國家藥監局將組織開展對進口化妝品生產企業現場檢查工作。本著公平競爭、國內國外一致原則,參照藥品醫療器械境外檢查相關工作程序。2019年5月,國家藥監局著手起草了《化妝品境外檢查暫行管理規定(征求意見稿)》(簡稱《規定》)。現于2019年11月22日向社會公開征求意見。公開征求意見的時間是2019年11月22日—12月22日。有關單位和個人可將意見反饋至hzpjgc@nmpa.gov.cn,請在電子郵件主題注明“化妝品境外檢查暫行管理規定”。
《規定》正文共5章,36條,并附6個輔助性文件。
第一章 總則 (第一至第八條) |
第二章 檢查計劃和準備 (第九至第十五條) |
第三章 檢查實施 (第十六至二十四條) |
第四章 審核及處理 (第二十五至三十三條) |
第五章 附 則(第三十四至三十六條) |
總則主要內容
- 化妝品境外檢查定義
指國家藥品監督管理局(以下簡稱國家局)為確認化妝品境外研制、生產相關過程及申報資料的真實性、可靠性和合規性所實施的境外現場檢查。
- 主管當局
國家局:負責化妝品境外檢查管理工作
國家局食品藥品審核查驗中心(簡稱核查中心):負責化妝品境外檢查的具體組織實施
- 檢查要求、基本情況和處理結果對外公開
- 檢查員保守國家秘密、工作秘密和被檢查單位的秘密
檢查計劃和準備主要內容
- 強調了境外檢查基于風險控制的原則,優先選擇在產品注冊備案、檢驗、不良反應監測、投訴舉報等環節發現有關問題,以及產品進口量大、在國內市場有較多消費者和較高影響度的企業進行檢查。安全風險因素包括:
(一)審評審批過程發現潛在風險的;
(二)檢驗結果不符合規定,提示質量體系存在安全風險的;
(三)不良反應監測提示可能存在產品安全風險的;
(四)投訴舉報或其他線索提示存在違法違規行為的;
(五)注冊人或者備案人存在不良記錄或失信行為的;
(六)境外監管機構公開信息提示注冊人或備案人質量管理體系或產品存在較大風險的;
(七)其他需要開展境外檢查的。
- 境外檢查計劃流程
境外檢查工作語言為中文,注冊人或者備案人提交的申報資料、整改報告等材料應當為中文版本,檢查期間應當配備可滿足檢查需要的翻譯人員。
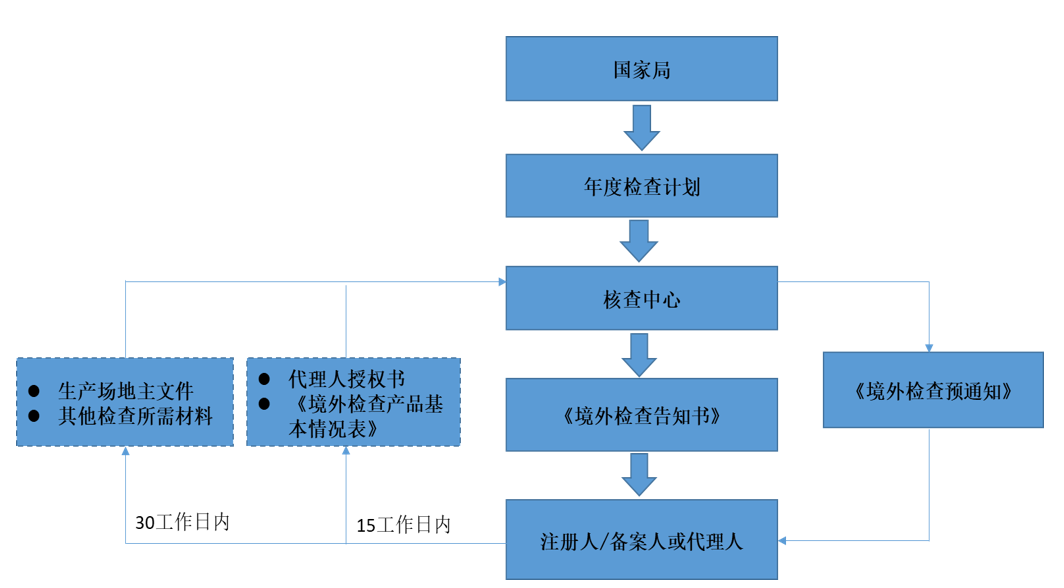
化妝品生產場地主文件:描述化妝品注冊人或者備案人生產工廠或委托生產工廠質量管理體系的文件。 境外檢查事務代理人:由注冊人或者備案人指定1家中國境內機構(其在華分公司、辦事處或代理商)。 代理人負責藥品監管部門與注冊人或者備案人之間的聯絡、承擔化妝品不良反應監測、負責產品追溯召回等工作。代理人應當履行法律法規所規定的境內上市化妝品有關責任和義務,協助藥品監管部門開展對產品境外研制、生產場地的檢查和違法違規行為的查處。 |
檢查實施主要內容
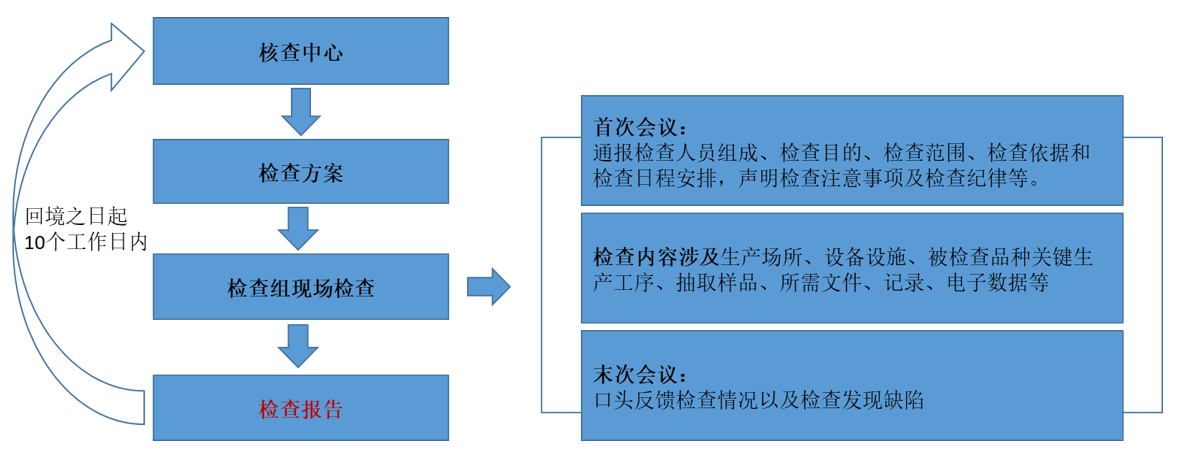
- 境外檢查工作流程
檢查組一般由3至5名檢查員組成,檢查組實行組長負責制。檢查人員應當是依法取得國家級檢查員資格的監管人員。檢查人員應當簽署無利益沖突聲明、檢查員承諾書和保密承諾書。
審核及處理主要內容
- 境外檢查結果審核流程
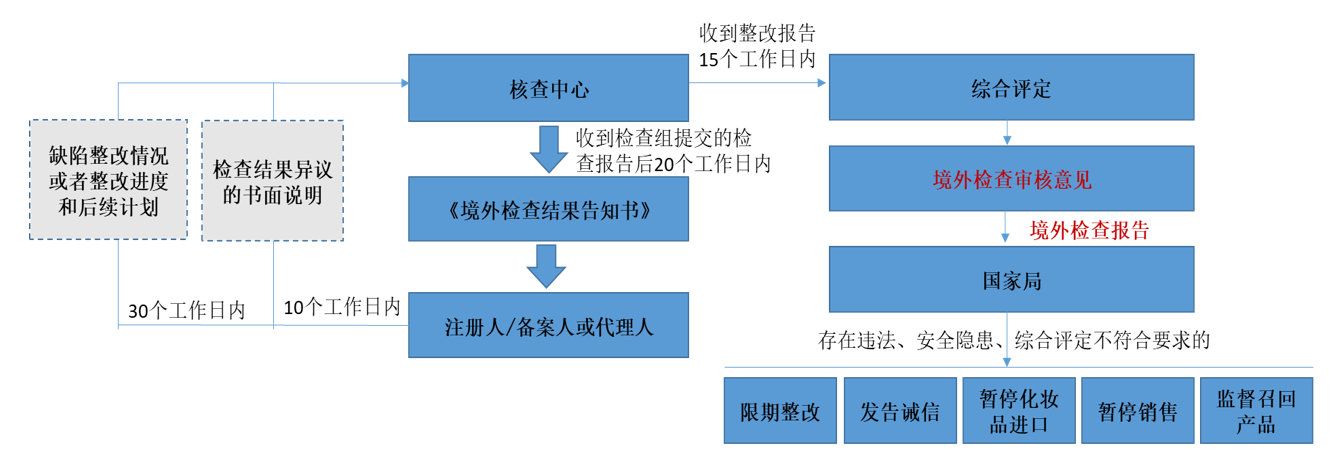
綜合評定采用風險評估原則,綜合考慮缺陷的性質、嚴重程度、頻次以及產品的類別等。判定原則如下: (一)符合要求:現場檢查未發現缺陷或僅發現輕微缺陷的。 (二)整改后符合要求:現場檢查發現的所有嚴重缺陷和一般缺陷的整改措施,表明注冊人或者備案人能夠采取有效措施進行改正,能夠按照法律法規及技術規范要求組織生產的。 (三)不符合要求:現場檢查發現存在真實性問題、影響產品質量的關鍵要素與注冊或備案資料不一致、生產質量體系存在《化妝品生產許可檢查要點》5項以上(含5項)嚴重缺陷或者20項以上(含20項)一般缺陷、整改工作不到位等不符合法律法 規及技術規范要求的。 |
存在下列情形之一的,視為注冊人或者備案人拖延、阻礙、限制或者拒絕檢查,直接判定為“不符合要求”:
(一)《境外檢查告知書》送達后,未在規定時限內提供符合要求代理人授權文件或其他要求的文件、資料的;
(二)注冊人或者備案人拒絕或者兩次推遲安排檢查的;
(三)不配合辦理境外檢查手續的;
(四)拖延、阻礙、限制、拒絕檢查人員進入被檢查場所或者區域的,或者限制檢查時間、設定不合理檢查條件或者干擾檢查的,或者不按照要求安排動態生產的;
(五)拖延、拒絕提供或者故意隱藏關鍵檢查信息的;
(六)拒絕或者限制檢查員收集證據相關資料的;
(七)其他不配合檢查的情形。
附則主要內容
《規定》適用于香港特別行政區、澳門特別行政區和臺灣地區注冊人或者備案人的產品研制、生產相關過程的現場檢查。
瑞旭評論
1) 根據《化妝品監督管理條例(征求意見稿)》第五十二條內容提到國務院藥品監督管理部門可以對進口化妝品注冊申報材料的真實性以及境外生產企業是否符合化妝品生產質量管理規范等要求,實施現場檢查。該《規定》將作為即將出臺的《化妝品監督管理條例》的配套法規文件。
2) 境外檢查事務代理人的責任與進口非特備案境內責任人性質相同。但不同于進口特品的在華申報責任單位。
3) 國家局逐步統一國產與進口化妝品事后監管方式和要求。
4) 境外檢查基于風險控制的原則,屬于以下范圍的產品或企業將作為政府優先選擇的對象:a)產品注冊備案資料存在真實性、可靠性和合規性風險的; b) 市場熱度高的產品; c) 進口量大的產品;d) 安全風險較高的產品類型如嬰幼兒、美白、防曬、染發等;e)信用不良企業;f) 知名品牌企業。
