隨著醫療器械監管法規體系不斷完善與規范化,醫療器械生監督檢查及飛行檢查也將成為日常,醫療器械生產企業應依據醫療器械生產質量管理規范及相關法規要求,定期在企業內部開展生產質量管理體系自查并將缺陷部分進行分析與整改,提交企業生產和質量管理水平,保證生產質量管理體系的有效運行,從容應對監管部門的監督檢查或飛行檢查。
體系審查與整改咨詢電話:0571-87206527 或 010-83123902
一、醫療器械體系審查內容
醫療器械體系審查主要關注與產品研制、生產有關的設計開發、采購、生產管理和質量控制等內容,重點核查設計開發、生產等過程數據真實可靠、完整、可追溯。
項目 | 主要審查內容 |
1. 機構與人員 | 組織機構、相關人員專業背景、資質及工作技能 |
2. 廠房、設備與設備 | 產品研發、樣品試制相適應的廠房、設施、設備和儀器,滿足質量控制要求 |
3. 文件管理 | 設計開發及研制原始資料,研究數據的真實性、完整性和可追溯性,研制過程記錄如主要物料領用記錄、儀器設備使用記錄、稱量記錄、配制記錄等,增加研發過程的可追溯性。 |
4. 設計開發 | 醫療器械設計開發文檔源于設計開發評審、驗證、確認和設計轉換活動的相關文件,包含設計開發程序、開發計劃及建立的記錄,保證對歷次設計開發最終輸出過程及其相關活動的可追溯性。 |
5. 采購 | 原輔料合法來源證明,檢驗報告、采購控制記錄及供應商管理。 |
6. 生產 | 關鍵工藝和方法確認,樣品生產記錄可追溯,確保在實際生產體系下生產樣品。 |
7. 質量控制 | 樣品生產過程檢驗記錄可追溯,樣品去向可追溯等。 |
真實性核查 | - 產品注冊檢驗樣品真實性 - 臨床試驗樣品真實性 - 樣品和生產地址與申報生產地址一致性 - 試生產的樣品批次及批號、規格、每批數量、送檢樣品和臨床樣品批號及數量、留樣品批號及數量、現存樣品批號及數量、主要原材料數量等可追溯 - 過程檢驗原始記錄、出廠檢驗原始記錄滿足設計輸出檢驗規程與產品技術要求 - 樣品臺帳、留樣記錄 - 原材料采購記錄 |
二、醫療器械體系審查及整改流程
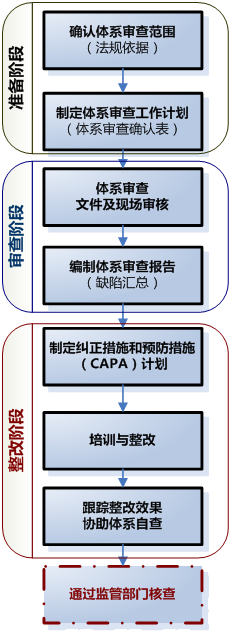
三、醫療器械體系常見缺陷項及整改建議
常見缺陷項 | 整改建議 |
1.缺少人員培訓的相關記錄 | 應當進行符合《醫療器械生產質量管理規范》及相關附錄中要求的與其崗位要求相適應的培訓,留下培訓相關記錄。 |
2.生產管理不到位 | 制定受控的關鍵或特殊過程的作業指導書,對關鍵或特殊過程的重要參數進行驗證或確認,符合《醫療器械生產質量管理規范》中應當明確關鍵工序和特殊過程并編制相應規程或指導書的要求。 |
3. 質量控制文件缺失或擅自更改、質量控制不到位 | 1)明確描述產品抽驗方法及判定規則,符合《醫療器械生產質量管理規范》中要求按強制性標準以及經注冊或者備案的產品技術要求制定的產品檢驗規程。 2)產品檢驗按產品技術要求的規定執行,符合《醫療器械生產質量管理規范》中對產品檢驗的相關要求。 3)現場合理擺放產品標識及檢驗狀態標識,符合《醫療器械生產質量管理規范》中對標識的相關要求。 4)制定產品放行程序,明確放行程度、條件和放行標準,符合《醫療器械生產質量管理規范》中對放行的相關要求。 |
4.未對質量管理體系的運行進行評價和審核 | 定期對產品質量及質量管理工作進行審核、評審和記錄,符合《醫療器械生產質量管理規范》要求定期開展管理評審和內審,以確保其持續的適宜性、充分性和有效性。 |
5.部分廠房設施不滿足生產條件 | 廠房各區域修建根據區域情況符合《醫療器械生產質量管理規范》及相關附錄中要求,滿足相應儲存條件的要求,滿足產品的生產、儲存、檢驗條件,且各區域具備溫濕度等環境監視管理設備,產品各部分在對應區域生產、儲存、檢測。 |
6.設計開發管理不到位 | 提供完整的產品設計開發文檔,產品輸出內容齊全,保持設計開發更改記錄并符合《醫療器械生產質量管理規范》中對更改進行識別并保持紀錄的要求。 |
7.不合格品控制不到位 | 不合格品、待檢品和合格品三者均單獨設立區域進行標識區分,使其隔離,對應記錄完善真實,定期進行評審。 |
