1. 產品概述
1.1產品名稱
一次性使用手術衣
1.2結構組成
通常為基材和阻水層組成的手術室服裝。基材一般由非織造布或紡織布制造,阻水層為阻水性的材料。非無菌提供可重復使用,由前身、后身、袖子、系帶等組成。
產品圖示舉例:
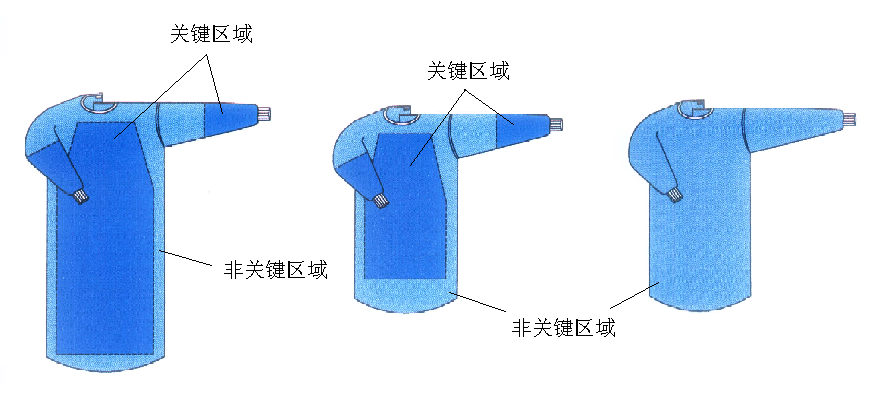
1.3預期用途
用于穿在手術醫生和擦拭護士身上,起到防止醫生身體上的皮屑彌散到開放的手術創面和手術病人的體液向醫務人員傳播,起到雙向生物防護的作用。
1.4適用人群
醫療機構手術室醫務人員。
1.5預期使用環境
醫療機構手術室
2. 分類信息
一次性使用手術衣分類編碼為14-13-05,按照第II類醫療器械管理,其分類信息如下表:
表1 分類信息
子目錄 | 一級 | 二級 | 產品描述 | 預期用途 | 品名舉例 | 類別 |
14 注輸、護理和防護器械 | 13 手術室感染控制用品 | 05手術室用衣帽 | 通常為基材和阻水層組成的手術室服裝。基材一般由非織造布或紡織布制造,阻水層為阻水性的材料。手術衣分為無菌提供一次性使用和非無菌提供可重復使用兩種供應形式。手術衣按關鍵區域的屏障能力分為標準型和高性能型兩種。手術帽為無菌提供,一次性使用。 | 用于穿在手術醫生和擦拭護士身上,起到防止醫生身體上的皮屑彌散到開放的手術創面和手術病人的體液向醫務人員傳播,起到雙向生物防護的作用。 | 手術服、手術衣、外科手術衣、一次性使用無菌手術衣、非織造布手術衣、一次性無菌手術衣、一次性使用無菌手術服、一次性使用手術帽、一次性使用無菌帽 | Ⅱ |
3. 注冊單元
3.1注冊單元劃分
按照醫療器械注冊管理辦法第二十七條要求,“醫療器械產品的注冊單元原則上以技術結構、性能指標和預期用途為劃分依據”。
根據以上原則,高性能和標準性能的手術衣可以作為一個注冊單元。
3.2同一注冊單元中典型產品的確定
(1)同一注冊單元中典型產品是指能夠代表本注冊單元內其他產品安全性和有效性的產品,其功能最齊全,結構最復雜,風險最高。
(2)典型產品的確定可以通過比較同一注冊單元內所有產品的技術結構、性能指標和預期用途等相應資料,說明能夠代表本注冊單元內其他產品的安全性和有效性。
(3)舉例:高性能手術衣與標準性能手術衣相比,高性能手術衣性能指標要求更高。所以高性能手術衣和標準性能手術衣作為一個注冊單元時,高性能手術衣應作為這個注冊單元中的典型產品。
4. 臨床試驗要求
一次性使用手術衣已經列入免臨床目錄,免臨床描述見下表:
表2 免臨床目錄信息
分類編碼 | 產品名稱 | 產品描述 | 類別 |
14-13-05 | 一次性使用手術衣帽 | 一次性使用手術衣帽一般由具有一定防護特性的無紡布或覆膜無紡布復合材料制成;其中手術衣可由衣領、衣身、衣袖組成,也可由上衣、褲子組成,袖口、腳踝口為彈性收口,腰部收口可采用彈性收口、拉繩收口或搭扣;前襟、肘部等可設計成加強防護,以無菌形式提供,供手術人員穿著,降低感染源向病人手術創面傳播以防止術后創面感染;具有阻止液體透過的手術衣,也可減小血液或體液中攜帶的感染源向手術人員傳播的風險。產品性能指標采用下列參考標準中的適用部分,如: YY/T 0506 病人、醫護人員和器械用手術單、手術衣和潔凈服。 | Ⅱ |
本產品設計定型、工藝成熟,臨床應用多年,不改變常規用途,且無嚴重不良事件記錄,通過非臨床評價、注冊檢驗及質量體系考核能夠保證產品的安全性、有效性,故原則上不要求臨床試驗。
5. 技術要求
1.關鍵區域的劃分
手術衣的前胸和袖部至少應有關鍵區域,如圖2所示的A區域和B區域。
手術衣前胸部關鍵區域上邊緣離領口的距離不大于10cm,關鍵區域的長度不少于70cm。關鍵區域的寬度應不小于45cm。
手術衣袖部關鍵區域至少為從腕關節(不包括袖口)到肘關節的環臂區域。
注:有些特殊手術,如骨科手術可能需要全袖均為關鍵區域。
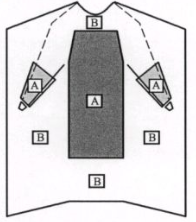
圖2 手術衣關鍵區域與非關鍵區域圖示
(A為關鍵區域,B為非關鍵區域)
2.性能
手術衣關鍵區域包括關鍵區域內部結合處應符合YY/T 0506.2-2016中表1規定的相應級別的關鍵區域的要求。
手術衣關鍵區域與非關鍵區域的結合處(若有)應符合YY/T 0506.2-2016中表1規定的非關鍵區域的要求。
手術衣非關鍵區域包括非關鍵區域內部結合處(若有)應符合YY/T 0506.2 -2016中表1規定的非關鍵區域的要求。
注1:結合處的性能要求不適用于袖口的結合處和領口的鎖邊處。
注2:肩部、腋部結合處不要求抗滲水性和阻干態微生物穿透。
3.規格
手術衣的橫向尺寸應能將適用體形的醫生除頭部以下的周身全部覆蓋,以起到組織醫生皮屑向手術區域彌撒的作用。制造商應給出手術衣尺寸的圖示和規格,以供使用者選擇。
常用手術衣的規格示例:
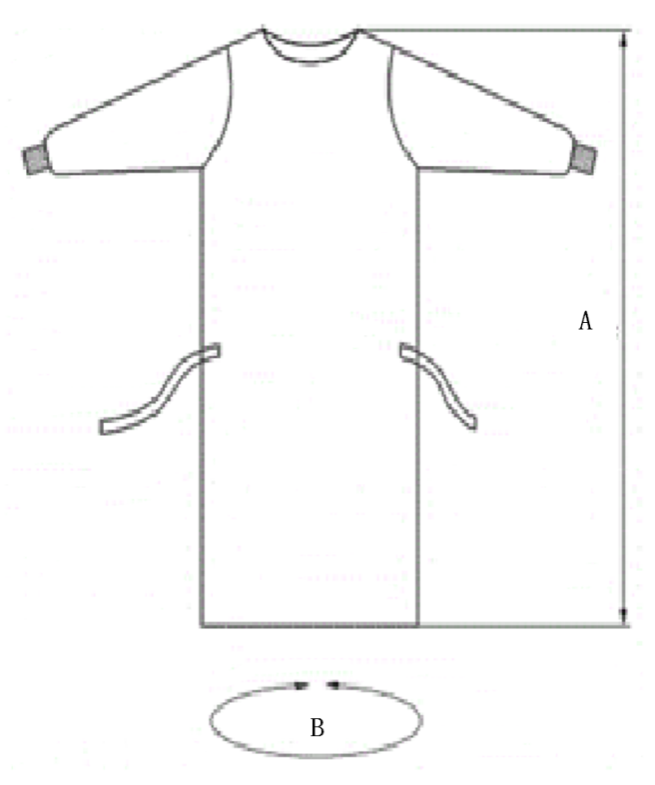
圖3 手術衣型式和規格示例圖(A:衣長;B:展開衣寬)
表3 手術衣規格尺寸 單位:厘米
規格 | A(衣長) | B(展開衣寬) |
S | 115 | 140 |
M | 120 | 150 |
L | 130 | 160 |
XL | 140 | 170 |
XXL | 150 | 175 |
XXXL | 170 | 180 |
偏差 | ±2 | ±2 |
4.透氣性
若制造商聲稱產品具有高透氣性,按照YY/T 0506.2-2016中B.2規定的方法進行試驗,其非關鍵區域的透氣性應不低于150 mm/s。
注:高透氣性手術衣適用于手術時間較長、醫護人員對手術衣舒適性要求高的手術。
5.折疊
制造商應對手術衣的折疊形式進行確認,以確保其以最小污染、便于無菌操作的方式穿到手術醫生的身上。
6.系帶連接牢固性
手術衣頸部及腰部的系帶應能承受10N的軸向靜拉力,持續1min無斷裂或脫落現象。
7.滅菌要求
7.1無菌保證
一次性使用手術衣應無菌供應,應符合YY/T 0615.1的要求。
7.2環氧乙烷殘留量
一次性使用手術衣若采用環氧乙烷滅菌,按照GB/T 16886.7規定的方法或等效方法試驗時,環氧乙烷殘留量應不大于 5 μg/g。
6. 主要參考技術標準或規范
主要參考技術標準 | GB 18278.1-2015醫療保健產品滅菌 濕熱 第1部分:醫療器械滅菌過程的開發、確認和常規控制要求 GB 18279.1-2015醫療保健產品滅菌 環氧乙烷 第1部分:醫療器械滅菌過程的開發、確認和常規控制的要求 GB 18280 醫療保健產品滅菌 輻射 GB/T 16886.1-2011醫療器械生物學評價 第1部分:風險管理過程中的評價與試驗 GB/T 16886.7-2015 醫療器械生物學評價 第7部分:環氧乙烷滅菌殘留量 GB/T 16886.10-2017 醫療器械生物學評價 第10部分:刺激與皮膚致敏試驗 GB/T 19633 最終滅菌醫療器械包裝 GB/T 14233.1-2008 醫用輸血、輸液、注射器具檢測方法 第1部分:化學分析方法 GB/T 14233.2-2005 醫用輸血、輸液、注射器具檢測方法 第2部分:生物試驗方法 YY/T 0313-2014醫用高分子產品 包裝和制造商提供信息的要求 YY/T 0287-2017 醫療器械 質量管理體系用于法規的要求 YY/T 0466.1-2016醫療器械用于醫療器械標簽、標記和提供信息的符號 第1部分:通用要求 YY/T 0615.1-2007 標示“無菌”醫療器械的要求 第1部分:最終滅菌醫療器械的要求 YY/T 0316-2016 醫療器械 風險管理對醫療器械的應用 YY /T 0506.1 病人、醫護人員和器械用手術單、手術衣和潔凈服第1部分:制造廠、處理廠和產品的通用要求 YY /T 0506.2 病人、醫護人員和器械用手術單、手術衣和潔凈服第2部分:性能要求和性能水平 YY /T 0506.4 病人、醫護人員和器械用手術單、手術衣和潔凈服第4部分:干態落絮試驗方法 YY /T 0506.5 病人、醫護人員和器械用手術單、手術衣和潔凈服第5部分:阻干態微生物穿透試驗方法 YY /T 0506.6 病人、醫護人員和器械用手術單、手術衣和潔凈服第6部分:阻濕態微生物穿透試驗方法 YY/T 0506.7 病人、醫護人員和器械用手術單、手術衣和潔凈服 第7部分:潔凈度-微生物試驗方法 YY/T 0506.8 病人、醫護人員和器械用手術單、手術衣和潔凈服 第8部分:產品專用要求 中華人民共和國藥典 |
指導原則 | 一次性使用手術衣產品注冊技術審查指導原則 (食藥監辦械函[2011]187號) |
7. 手術衣主要檢測機構
山東省醫療器械產品質量檢驗中心(YY/T 0506.8標準歸口單位)
廣東省醫療器械質量監督檢驗所
北京市醫療器械檢測所
8. 一次性使用手術衣產品的主要風險
一次性使用手術衣產品的風險分析報告應符合YY/T 0316-2016《醫療器械 風險管理對醫療器械的應用》的有關要求。以下依據YY/T 0316的附錄D從三個方面列舉了一次性使用手術衣產品的危害因素。
產品主要危害
危害 類型 | 可能產生的危害 | 形成因素 | 控制措施 |
生物學危害 | 生物污染 | 產品沒有滅菌或滅菌沒有達到標準 | 嚴格控制滅菌工藝 |
環境污染 | 生產環境污染產品,如包裝破損、外來的纖維、粉塵、細菌、其它雜質等 | 嚴格控制生產環境及包裝工藝 | |
生物相容性 | 生產引入了外來有害物質沒有被有效去除;環氧乙烷殘留量超標 | 原材料入廠檢驗; 嚴格控制滅菌工藝 | |
與產品使用相關的危害 | 不適當的標簽 | 外部標記不全面、標記不正確或不能夠清楚易認 | 標記印刷清晰正確;標記內容按相關要求標記全面。 |
說明書上的注意事項不全 | 如缺少詳細的使用方法、缺少必要的警告說明; 使用前未檢查產品滅菌或包裝狀態; 產品等級標示不清 | 規范說明書; 說明書上提示 | |
由不熟練或未經訓練的人員使用 | 使用者未經培訓或培訓不足,不能正確使用產品; | 使用前培訓 | |
對一次性使用產品的很可能再次使用的危害性警告不適當 | 說明書中未包含只限一次性使用 | 規范說明書 | |
功能失效引起的危害 | 不適當的預期用途表述 | 說明書中未能清楚表明產品用途 | 規范說明書 |
不適當的產品包裝 | 生產、運輸、搬運和儲存過程中導致包裝破損; 包裝封口不嚴密; 包裝材料選擇不適當 | 規范包裝 | |
失去產品的完整性 | 產品各構件之間縫制或粘合達不到隔離要求; | 嚴格控制生產工藝、產品檢驗 |
