近年來,以中國為代表的新興醫療器械市場發展迅速,相應地審評對于醫療器械注冊申報要求也越來越嚴格,其中原材料是醫療器械產品實現其預期功能的重要載體,也是器械安全性和有效性的重要保障。國家藥監局審評中心希望注冊申請人能夠充分披露原材料信息,但是原材料生產商出于商業秘密的考量有保留地提供相關資料,基于此背景,主文檔制度的出臺是為了解決企業保護商業秘密的需求和審評機構要求對信息充分披露之間的矛盾。
2018年12月國家藥監局為鼓勵創新、優化注冊申報流程,落實中共中央辦公廳 國務院印發的《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》精神,主文檔中心項目組針對國內外主文檔管理工作進行調研并結合我國實際情況發布了醫療器械主文檔登記事項的4個相關文件,對外公開征求意見。征求意見稿是主文檔相關文件對外征求意見稿一經發布即得到行業內的廣泛關注。
2021年3月12日國家藥監局正式發布《醫療器械主文檔登記事項的公告》,與征求意見稿相比,調整了內容布局,邏輯條理更加清楚易懂;增加了《境內醫療器械主文檔登記更新資料電子目錄》;提示更新需提交全套主文檔資料;取消紙質資料提交,明確申報形式與CA注冊申報一致,已在系統中增加主文檔端口。
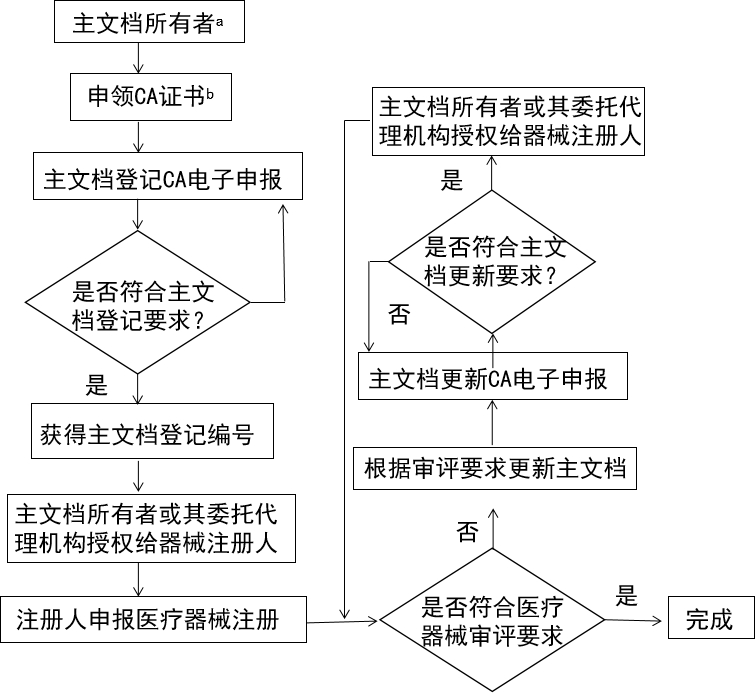
主文檔由其所有者自愿提交登記申請,監管機構對主文檔進行登記。在登記時不經過實質審評,待關聯醫療器械注冊申請受理后一并審評。
主文檔登記流程