隨著韓國疫情的加重,韓國國內口罩產品出現供應緊張問題,韓國政府一方面下達口罩和消毒產品出口禁令,基本取消口罩出口,鼓勵加急生產;另一方面簡化口罩進口的審批流程,由常規許可改為快速許可,確保疫情期間口罩供給。眾所周知韓國對口罩產品監管非常嚴格,此次進口口罩審批流程的簡化一定程度上為國外口罩企業的對韓出口提供便利條件,緩解韓國國內口罩的供應壓力。
為了幫助口罩企業快速獲得出口韓國許可,瑞旭集團旗下韓國公司(CIRS Korea)及北京公司(北京西爾思科技有限公司)聯合整理了口罩在韓國的監管政策及口罩如何快速出口韓國,供口罩企業參考。
口罩韓國快速申報咨詢聯系方式:
語言 | 聯系人 | 電話 | 郵箱 |
中文&韓語 | 張蕾 | 010-8312 3902 (北京) | Zhanglei@cirs-groupc.com |
中文 | 張九江 | 0571-8720 6527 (杭州) | zjj@cirs-group.com |
韓語&英語 | Haram.Lee | +82-02-6347-8803 (韓國) |
一. 韓國口罩分類
韓國口罩主要分為保健用口罩、手術用口罩和防護口罩。保健用口罩按照過濾效率分為KF88級、KF94級和KF99級;手術用口罩暫無分類;防護口罩按照隔離粉塵類型分為特級、1級、2級三個等級,按照過濾元件連接方式分為分離式和隨棄式,其中分離式又分為隔離式和直接連接式,按照覆蓋范圍分為全面罩、半面罩。
保健用和手術用口罩屬于醫藥外品,按照醫藥外品許可類管理;防護口罩屬于工業防護用品,上市前需獲得KCs認證。
類別 | 等級 | 審批分類 |
保健用口罩 | KF80、KF94、KF99 | 醫藥外品 許可類 * |
手術用口罩 | - | 醫藥外品 許可類 * |
防護口罩 | 特級、1級、2級; 分離式(隔離式、直接連接式),隨棄式; 全面罩、半面罩 | KCs 認證 |
普通口罩 | - | |
* 醫藥外品審批包括許可類和備案類,保健用口罩和手術用口罩都屬于許可類。 | ||
二、韓國口罩監管要求
分類 | 保健用口罩、手術用口罩 | 防護口罩 |
監管部門 | 食品醫藥品安全處(MFDS) | 安全保健公團(KOSHA) |
審批部門 | 食品醫藥品安全處(MFDS) | 產業安全保健認證院(OSHCI) |
審批分類 | 醫藥外品許可 | KCs認證 |
法規依據 | 《藥事法》 《藥事法施行令》 《醫藥品等制造業及進口商設施基準令》 《醫藥品等制造業及進口商設施基準令施行規則》 《醫藥品等安全相關規則》 | 《產業安全保健法》 《產業安全保健法施行令》 《產業安全保健法施行規則》 《防護用品安全認證公告》 |
分類 | 韓國保健用口罩 | 韓國防護口罩(隨棄式) | 中國防護口罩(隨棄式) | |||||
過濾效率 | KF80 | ≥80 % (氯化鈉顆粒物) | 2級 | ≥80 % (氯化物&石蠟油顆粒物) | KN90 | ≥90.0 % (氯化鈉顆粒物) | KP90 | ≥90.0 % (油類顆粒物) |
KF94 | ≥94 % (氯化物&石蠟油顆粒物) | 1級 | ≥94 % (氯化物&石蠟油顆粒物) | KN95 | ≥95.0 % (氯化物顆粒物) | KP95 | ≥95.0 % (油類顆粒物) | |
KF99 | ≥99 % (氯化物&石蠟油顆粒物) | 特級 | ≥99 % (氯化物&石蠟油顆粒物) | KN100 | ≥99.97 % (氯化物顆粒物) | KP100 | ≥99.97 % (油類顆粒物) | |
四、韓國口罩的申報流程
1.保健用口罩&手術用口罩的常規申報流程(以進口產品為例)
流程 | 周期 | 提交資料 | |
申報環節 | ①進口商申報醫藥外品進口資質 | - | *取得《醫藥外品進口業備案證》 |
②出口商與進口商簽訂合同。 | |||
③制定產品標準 | 70天 | - | |
④產品檢測 | 產品標準和檢測方法 | ||
⑤醫藥外品產品許可申報 | 1)生產證明 2)銷售證明 3)產品設計開發的研究資料 4)產品標準和檢測方法、產品檢測報告 5)穩定性研究資料(長期保存試驗資料或者加速試驗資料) 6)生物學評價資料 7)功能&效果證明資料 8)國外使用現況相關資料 7)與韓國國內同類產品的比對審核等 *取得《醫藥外品產品許可證(進口類)》 | ||
進口環節 | ⑥向韓國醫藥品進出口協會報告通關 | - | *簽發《標準通關預受理證》 |
⑦海關進口申報 | - | *簽發《進口申報單》 | |
⑧產品檢測(進口檢驗) | 30天 | *在指定檢測機構進行檢測 | |
⑨流通、銷售 | - | - | |
*因進口醫藥外品許可證是簽發給韓國進口商的,出口企業可選擇有進口資質、不參與實際貿易的企業作為名義進口商,可以避免貿易商獨攬產品的進口許可權。
2.疫情期間保健用口罩的快速申報、快速通關流程
流程 | 周期 | 提交資料 | |
申報環節 | ①進口商申報醫藥外品進口資質 | 25天 | *取得《醫藥外品進口業備案證》 |
②出口商與進口商簽訂合同,由進口商進行以下操作。 | |||
③醫藥外品產品許可申報 | 1個月 | 1)生產證明 2)銷售證明 3)KN95檢測報告(GB2626) 4)其他產品檢測報告 5)相關認證證書(如有,請提供) 6)產品設計開發的研究資料 7)穩定性研究資料 8)生物學評價資料 9)國外使用現況相關資料 備注: * 1)- 5)項為快速許可的必須資料。 6)- 9)可暫緩提供,但不得晚于6月30日,6月30日之前未能提交時取消許可。 * 取得《 醫藥外品產品許可證(進口)》 | |
進口環節 | ④向韓國醫藥品進出口協會報告通關 | - | 簽發《標準通關預受理證》 |
⑤海關進口申報 | - | 簽發《進口申報單》 | |
⑥產品檢測(進口檢驗) | 30天 | *在指定檢測機構進行檢測 | |
⑦流通、銷售 | - | - | |
3.防護口罩(以進口產品為例)
認證流程 | 周期 | 提交資料/審核資料 |
①出口商選定韓國代理人 | - | 委托書 |
②資料形式審核 | 30天 | 1)營業執照 2)進口證明 3)代理人委托書 4)口罩明細及使用說明書 5)口罩結構圖、配件圖 6)口罩照片、配件照片 |
③技術審核和生產體系審核 | 45天 | 1)質量管理體系的建立和實施方法 2)產品安全性的確認程序及內容 3)生產管理和產品出庫前后的管理程序和管理內容 4)生產和服務的改進程序 5)配件和產品的識別管理方劑及產品保存方法 6)生產監控、檢測設備及設備管理辦法 7)生產過程數據分析及預防和改善方法 8)不合格品處理程序 |
④產品檢測 | 60天 | 1)③的審核結果通知書 2)④的審核結果通知書 3)口罩材料檢測報告 |
五、口罩韓國申報預期周期
項目 | 認證周期 | 證書名稱 | 證書有效期 |
保健用口罩 | 常規申報:2-3個月 快速申報:1個月左右 | 醫藥外品產品許可證(進口) | 不設有效期 |
手術用口罩 | |||
防護口罩 | 5-6個月 | KCs安全認證證書 | 不設有效期 (定期審核) |
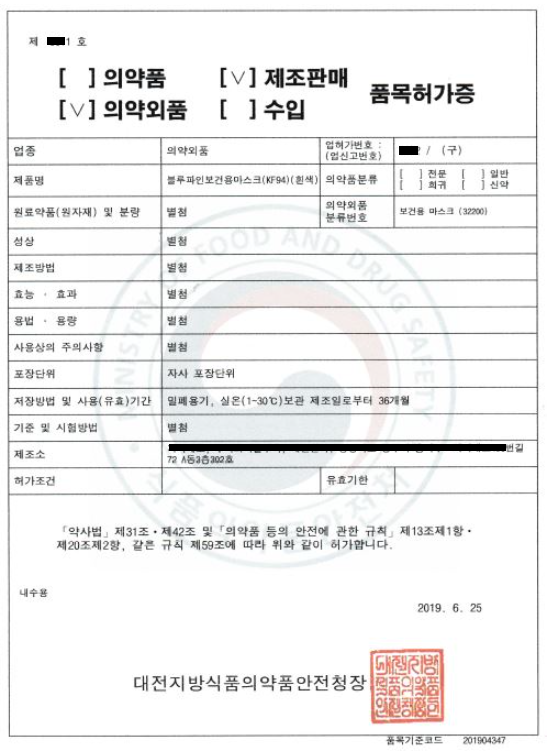
附:口罩韓國證書
1. 口罩 醫藥外品產品許可證
2. 防護口罩KCs安全認證證書

