為配套新修訂的《醫療器械監督管理條例》和《醫療器械注冊管理辦法》,國家藥品監督局于2021年9月30號發布了《關于公布醫療器械注冊申報資料要求和批準證明文件格式的公告(2021年第121號)》,對醫療器械申報資料的具體要求作出詳細解釋。該文件將在2022年1月1號開始實施。
新發布的醫療器械注冊申報資料從形式上與原43號令相比有了較大的變化,由原來的12大類資料修改為6類,對比關系詳見下圖。但從資料的內容上來說變化不大。
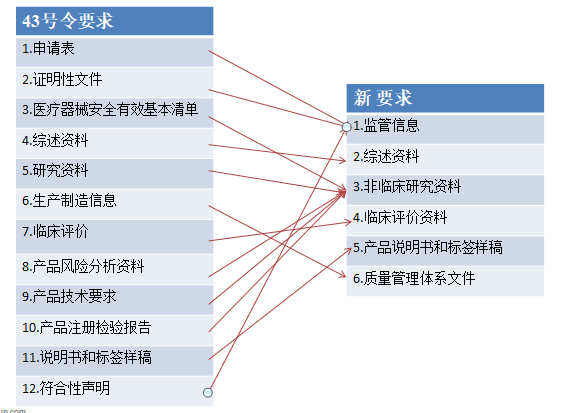
1.監管信息
監管信息包含了原申請表、證明性文件和符合性聲明,此外還增加了產品列表、主文檔授權函、與監管機構的溝通歷史記錄。產品列表與原4.3規格型號的要求基本一致,需要說明擬申報產品的型號、規格、結構組成、標識、尺寸等信息。而主文檔授權函則是為了適應主文檔登記制度的設立,一定程度上也解決了器械申請人無法提供原材料核心信息的問題。與監管機構的溝通記錄指的是通過會議形式的溝通或者有既往申報歷史的可根據情況提交相關溝通記錄。
2.綜述資料
與43號令相比,新的綜述資料的要求增加了申報產品上市歷史的要求,適用時,申請人應提供擬申報產品在不同國家(地區)的上市情況、不良事件和召回情況、銷售情況及不良事件及召回率。
3.非臨床研究資料
非臨床研究資料包括了原風險管理資料、技術要求及檢驗報告、醫療器械安全和性能基本原則清單、研究資料、穩定性研究資料、免臨床評價產品的對比資料。此外,增加了非臨床文獻資料,若申報申報產品具有非臨床文獻應提供文獻目錄及原文。研究資料中亦需關注化學/材料表征、互操作性。醫療器械安全和性能基本原則清單的內容也進行了調整。
4.臨床評價資料
臨床評價資料部分應闡述產品的研發背景包括現有的診斷或治療方法涉及的器械的臨床應用情況,申報產品與現有診斷和治療方法的關系、預期達到的臨床效果;臨床評價涵蓋范圍;臨床評價路徑;不同路徑的臨床評價具體資料。
5.說明書和標簽樣稿
說明書與標簽的要求與原43號文是一致的,并無變化。
6.質量管理體系文件
新的資料要求變化最大的就是需要在注冊申報時提交質量管理體系文件。質量管理體系文件除了原先注冊時提交的生產制造信息外,還包括原體系核查申請資料以及體系內的程序文件。這意味著,企業必須完成質量體系建設,做好體考準備后才能提出產品注冊申請。
延續注冊資料內容上與原要求一致,變更注冊文件增加了適用時質量管理體系文件的要求,適用情況包括變更的具體原因或目的涉及產品設計、原材料、生產工藝、適用范圍、使用方法變化的,需要針對變化部分進行質量管理體系核查的情形。
