【新規解讀】新體外診斷試劑注冊申報資料要求
——監管信息及安全性能清單
為配合新修訂的《醫療器械監督管理條例》(國務院令第739號)和《體外診斷試劑注冊與備案管理辦法》(國家市場監督管理總局令第48號),國家藥品監督局于2021年9月30號發布了《關于公布體外診斷試劑注冊申報資料要求和批準證明文件格式的公告》(2021年第122號),對體外診斷試劑注冊申報資料的具體要求作出詳細解釋。該文件將在2022年1月1號開始實施,原2014年44號文同時廢止。
本文主要介紹了新體外診斷試劑注冊申報資料要求中監管信息和安全性能清單部分內容要求。
1.關聯文件
(1)境內申請人
該部分新增了與“應急審批”“注冊人制度”“進口醫療器械在中國境內企業生產”相關的文件要求。
具體內容如下:
新增項目 | 應提交資料說明 |
按照應急審批程序審批 | 通過醫療器械應急審批的相關說明。 |
境內企業委托其他企業生產 | 1) 受托企業資格文件(營業執照副本復印件); 2) 委托合同; 3) 質量協議。 |
進口醫療器械在中國境內企業生產,以境內企業名義申報注冊 | 1) 該中國境內企業應為進口醫療器械注冊人在境內設立的外商投資企業; 2) 進口醫療器械注冊人同意注冊申報的聲明或授權文件; 3) 申請人與進口醫療器械注冊人關系(包括法律責任)的說明文件,應當附相關協議、質量責任、股權證明等文件。 |
(2)境外申請人
該部分新增了“未在境外上市的創新醫療器械”“應急審批”“境外醫療器械委托生產”相關的文件要求。
具體內容如下:
新增項目 | 應提交資料說明 |
未在境外企業注冊地或生產地所在國家(地區)上市的創新醫療器械 | 可以不提交境外申請人注冊地或生產地所在國家(地區)準許該產品上市銷售的證明文件; |
按照應急審批程序審批 | 通過醫療器械應急審批的相關說明。 |
境外企業委托其他企業生產 | 1) 受托企業資格文件 2) 委托合同 3) 質量協議。 |
備注:境外企業委托其他企業生產醫療器械,當該受托生產企業為中國境內企業時,應當由境內生產企業作為注冊申請人(備案人)申請注冊(辦理備案)。 | |
2.主文檔授權信
體外診斷試劑(IVD)的組成成分復雜,做好原材料的質控是確保診斷結果準確性的關鍵要素之一,考慮到原材料成分的復雜性、潛在的生物安全性,審評過程中可能會要求提供更多的原材料信息。為了方便醫療器械生產企業選擇原材料,同時簡化注冊申報,鼓勵境內第三類和進口第二類、第三類IVD原材料供應商可以進行醫療器械主文檔登記。
對于醫療器械注冊申請人,如引用主文檔,應提交由主文檔所有者或其備案代理機構出具的授權申請人引用主文檔信息的授權信(包括引用主文檔的申請人信息、產品名稱、已備案的主文檔編號、授權引用的主文檔頁碼/章節信息等內容)。
關于什么是醫療器械主文檔,如何進行醫療器械主文檔登記,請關注我們CIRS醫療器械公眾號,搜索“醫療器械主文檔”,會有專業講解內容。
3.申報前與監管機構的聯系情況和溝通記錄
關于這個部分的內容需要關注以下3點:
(1) 與監管機構的溝通記錄
指針對申報產品的以會議形式進行的溝通。
(2) 與既往注冊申報相關
既往注冊申報過程中,如該產品存在自行撤銷、藥監局不予注冊上市申請等情況,企業應提供a.既往注冊申報產品受理號 b.既往申報中監管機構已明確的相關問題。
(3) 不適用該部分的聲明
如果企業并不符合上述2條內容的描述,應當出具一份不適用聲明,明確申報產品沒有既往申報和/或申報前溝通。
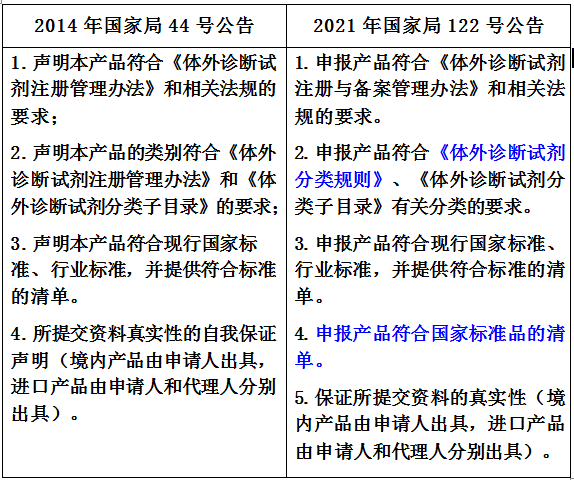
4.符合性聲明
下表分別列出了2014年國家局44號公告和2021年國家局122號公告關于符合性聲明部分的內容,如下所示,需要注意2點:
(1)有關分類的要求。由符合《體外診斷試劑注冊管理辦法》改為符合《體外診斷試劑分類規則》。新版的《體外診斷試劑注冊與備案管理辦法》中刪掉了關于IVD分類規則的內容,其內容全部調整到新發布的《體外診斷試劑分類規則》當中。
(2)關于申報產品符合國家標準品的清單。如IVD產品有適用的國家標準品,那么應列出適用國家標準品的清單;如果不適用,也應說明理由,并進行聲明。
5.體外診斷試劑安全和性能基本原則清單
參考《醫療器械安全和性能基本原則清單》,新的IVD注冊資料要求中也增加了針對IVD的安全和性能基本原則清單,從醫療器械通用原則和IVD特殊原則兩個方面,列出了IVD在實現預期功能、性能特性、風險管理、臨床評價、化學/物理/生物學、實際使用等方面的安全要求和性能要求。
IVD產品須符合相應要求,如果不適用應說明理由,并且在企業的注冊資料或者質量管理體系文件中應有相應的證據支持。
IVD安全和性能基本原則清單包括5個部分,如圖所示:
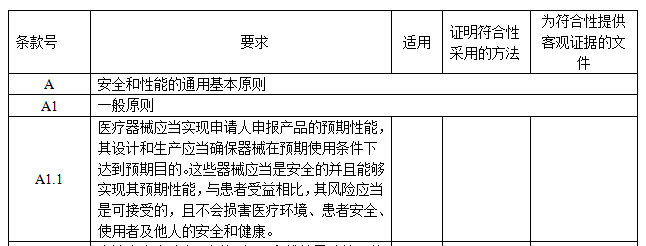
【適用】:如適用,填寫“是”;如不適用,填寫“否”,并說明理由。
【證明符合性采用的方法】:填寫證明該IVD產品符合安全和性能基本原則的方法,通常可采用以下方法來證明:
a. 符合已發布的醫療器械部門規章、規范性文件。
b. 符合醫療器械相關國家標準、行業標準、國際標準。
c. 符合普遍接受的測試方法。
d. 符合企業自定的方法。
e. 與已批準上市的同類產品的比較。
f. 臨床評價。
【為符合性提供客觀證據的文件】:填寫證據在申報資料中的具體位置,如不在申報資料中,可填寫證據文件名稱及其在質量管理體系文件中的編號。
填寫示例:


