依據2014年07月30日發布的《醫療器械注冊管理辦法》的要求,自2014年10月01日起,企業在醫療器械產品注冊(備案)過程中,需向食品藥品監督管理部門提供產品技術要求,同時,企業在進行醫療器械產品注冊檢驗時,也需向承檢的檢驗機構提供產品技術要求。
可見,醫療器械產品技術要求的作用是取代之前的醫療器械產品注冊標準,是醫療器械產品注冊標準的簡化版本。與注冊標準相比,技術要求主要有以下調整:
- 簡化注冊標準內容,只保留產品型號/規格及其劃分說明、性能指標、檢驗方法、術語以及附錄5部分。
- 有關產品生物學評價要求的內容可不必寫入產品技術要求。
- 產品技術要求將以附件的形式附加到醫療器械注冊證上。
基于此,企業在編制醫療器械產品技術要求時應當遵循以下原則:
- 醫療器械產品技術要求編號
醫療器械產品技術要求編號為對應產品的注冊證號(或備案號),新注冊(備案)產品的技術要求編號可留空。
- 產品名稱規范
產品技術要求中的產品名稱應使用中文,并與申請注冊(備案)的中文產品名稱相一致。
- 產品型號/規格及其劃分說明
產品技術要求中應明確產品型號和/或規格,以及其劃分的說明。對同一注冊單元中存在多種型號和/或規格的產品,應明確各型號及各規格之間的所有區別(必要時可附相應圖示進行說明),對于型號/規格的表述文本較大的可以附錄形式提供。
- 合理制訂性能指標要求
- 產品技術要求中的性能指標是指可進行客觀判定的成品的功能性、安全性指標以及質量控制相關的其他指標。產品設計開發中的評價性內容(例如生物相容性評價)原則上不在產品技術要求中制定。
- 產品技術要求中性能指標的制定應參考相關國家標準/行業標準并結合具體產品的設計特性、預期用途和質量控制水平且不應低于產品適用的強制性國家標準/行業標準。
- 產品技術要求中的性能指標應明確具體要求,不應以“見隨附資料”、“按供貨合同”等形式提供。
- 明確檢驗方法
檢驗方法的制定應與相應的性能指標相適應。應優先考慮采用公認的或已頒布的標準檢驗方法。檢驗方法的制定需保證具有可重現性和可操作性,需要時明確樣品的制備方法,必要時可附相應圖示進行說明,文本較大的可以附錄形式提供。
對于體外診斷試劑類產品,檢驗方法中還應明確說明采用的參考品/標準品、樣本制備方法、使用的試劑批次和數量、試驗次數、計算方法。
- 附錄形式提供附加信息
對于第三類體外診斷試劑類產品,產品技術要求中應以附錄形式明確主要原材料、生產工藝及半成品要求。
- 其它注冊事項
- 醫療器械產品技術要求的編制應符合國家相關法律法規及標準規范要求。
- 醫療器械產品技術要求中應采用規范、通用的術語。如涉及特殊的術語,需提供明確定義,并寫到“4.術語”部分。
- 醫療器械產品技術要求中的檢驗方法各項內容的編號原則上應和性能指標各項內容的編號相對應。
- 醫療器械產品技術要求中的文字、數字、公式、單位、符號、圖表等應符合標準化要求。
- 如醫療器械產品技術要求中的內容引用國家標準、行業標準或中國藥典,應保證其有效性,并注明相應標準的編號和年號以及中國藥典的版本號。
企業如何編制合格的醫療器械技術要求?
1. 編制流程
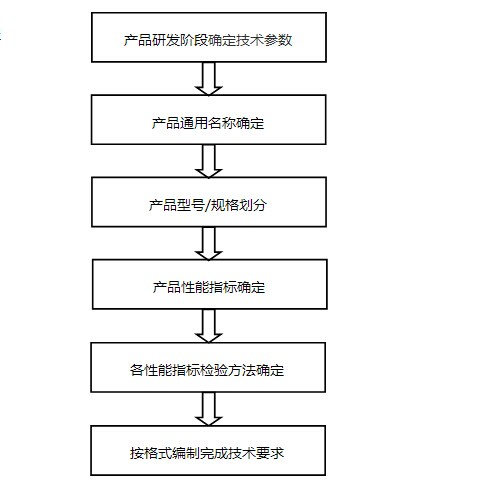
2. 編制方法
- 產品已發布國標或行業標準的,可參照國標或行標,結合產品特性編制;
- 產品已有注冊標準的,可參照同品種產品注冊標準或企業標準進行編制;
- 如產品已發布國際標準或國外已有同品種產品標準,可參照進行編制;
- 如產品為全新產品,企業可根據同類產品標準并結合產品自身特性進行編制;
- 編制過程中,所有檢驗方法必須符合中國相關檢驗標準或中國藥典所載方法要求,并經過國家藥監總局指定檢驗機構的驗證。
結束語
醫療器械技術要求的編制是對所注冊醫療器械產品的綜合性的識別定性過程,在編制過程中既要全面了解產品個性化的特性,又要熟悉產品在醫療器械法規下應滿足的技術要求, 因此編制醫療器械產品技術要求人員應同時熟悉產品技術特點、全面了解產品行業法規標準規范、精通醫療器械產品檢驗技術方法及具有標準編制技術基礎。 企業只有在編制出符合標準規范的產品技術要求,才能確保在產品注冊過程的順利進行,同時保障產品上市后風險。
