無論是器械還藥物想要在醫院開展臨床試驗,最關鍵的一步是通過醫院倫理委員會的審查。通過倫理審查,拿到倫理批件意味著申辦方第一份可以進行臨床試驗的官方許可文件。瑞旭技術為您整理了倫理委員會一般的審查流程及內容。
一般倫理審查流程: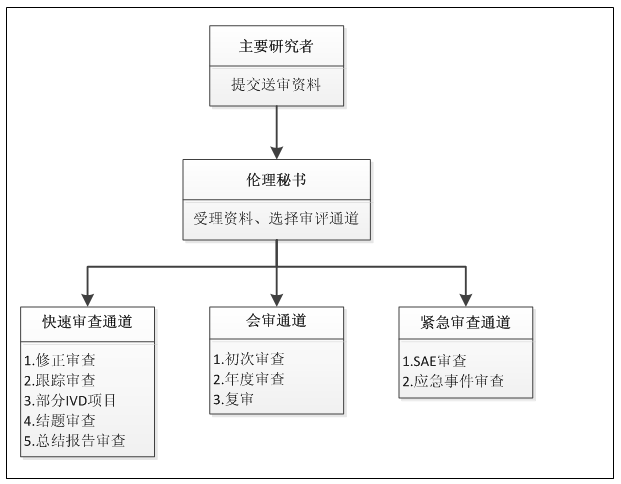
倫理審查內容:
1.臨床試驗方案的設計和實施:
1)設計的科學性:
- 充分的實驗室研究和動物實驗;
- 試驗設計和對照組設置的合理性;
- 入排標準、剔除標準等。
2)可執行性:試驗實施過程中的監查和稽查計劃。
2.研究者:
1)資質:執業醫師證書、GCP培訓;
2)能力:人員配備、設備條件符合臨床試驗要求;
3)執行力:有充足的時間開展臨床試驗。
3.與受試者相關:
1)風險與受益:對受試者有直接受益前景的試驗,預期受益與風險應至少與目前可獲得的替代治療的受益與風險相當;對受試者沒有直接受益前景的試驗,風險相對于社會預期受益而言,必須是合理的。
2)受試者招募方式和方法,向受試者或其代表告知有關試驗信息的方式。
3)知情同意書告知的信息:
臨床試驗相關信息;
- 受試者參加試驗是否需要承擔費用、是否獲得報酬;
- 能識別受試者身份有關記錄的保密程度;
- 如發生與試驗有關的損害時,可獲得治療和相應的補償等。
4.試驗用品:來源、質量、去向。
