
為構建科學的醫療器械監管體系,加快與國際接軌,2020年3月,我國等同轉化IMDRF第三版《醫療器械安全和性能基本原則》(以下簡稱《基本原則》)。《基本原則》是基于通用風險提煉出的醫療器械安全有效基本要求,注冊申請人應自覺履行主體責任,將《基本原則》要求融入醫療器械的研發和生產過程中,在質量管理體系的控制下,形成相應的符合性證據,注冊時作為證明產品安全有效的申報資料提交。
為進一步指導注冊申請人科學合理地運用《基本原則》進行產品研發和注冊申報,確保醫療器械安全有效,國家藥監局器審中心基于當前認知水平和審評工作實際情況,組織編寫了《<醫療器械安全和性能基本原則>符合性技術指南》,現予發布。
特此通告。
附件:1.醫療器械安全和性能基本原則符合性技術指南
2.醫療器械安全和性能基本原則符合性技術指南使用說明
國家藥品監督管理局
醫療器械技術審評中心
2022年7月12日
【附件1】
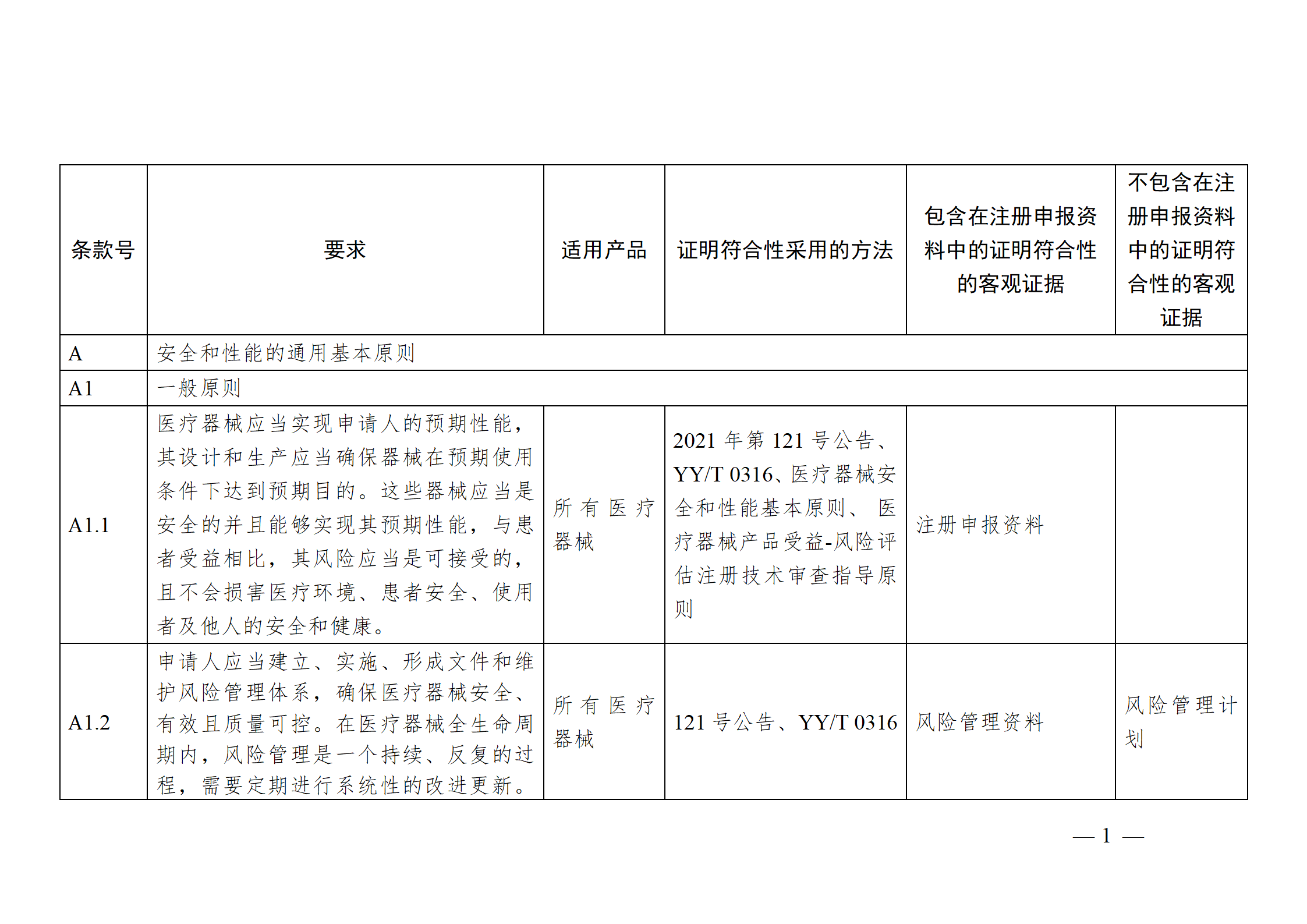
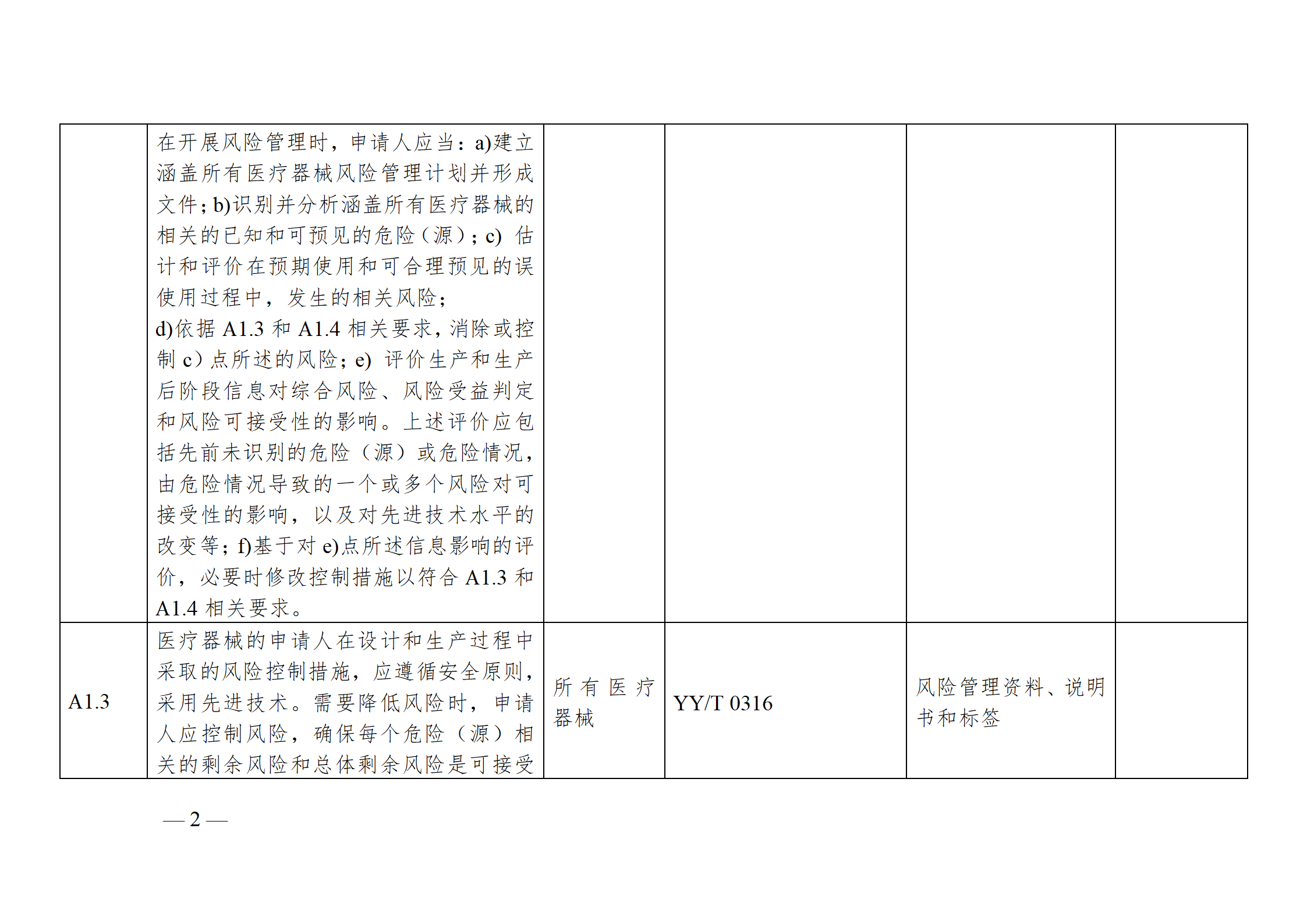
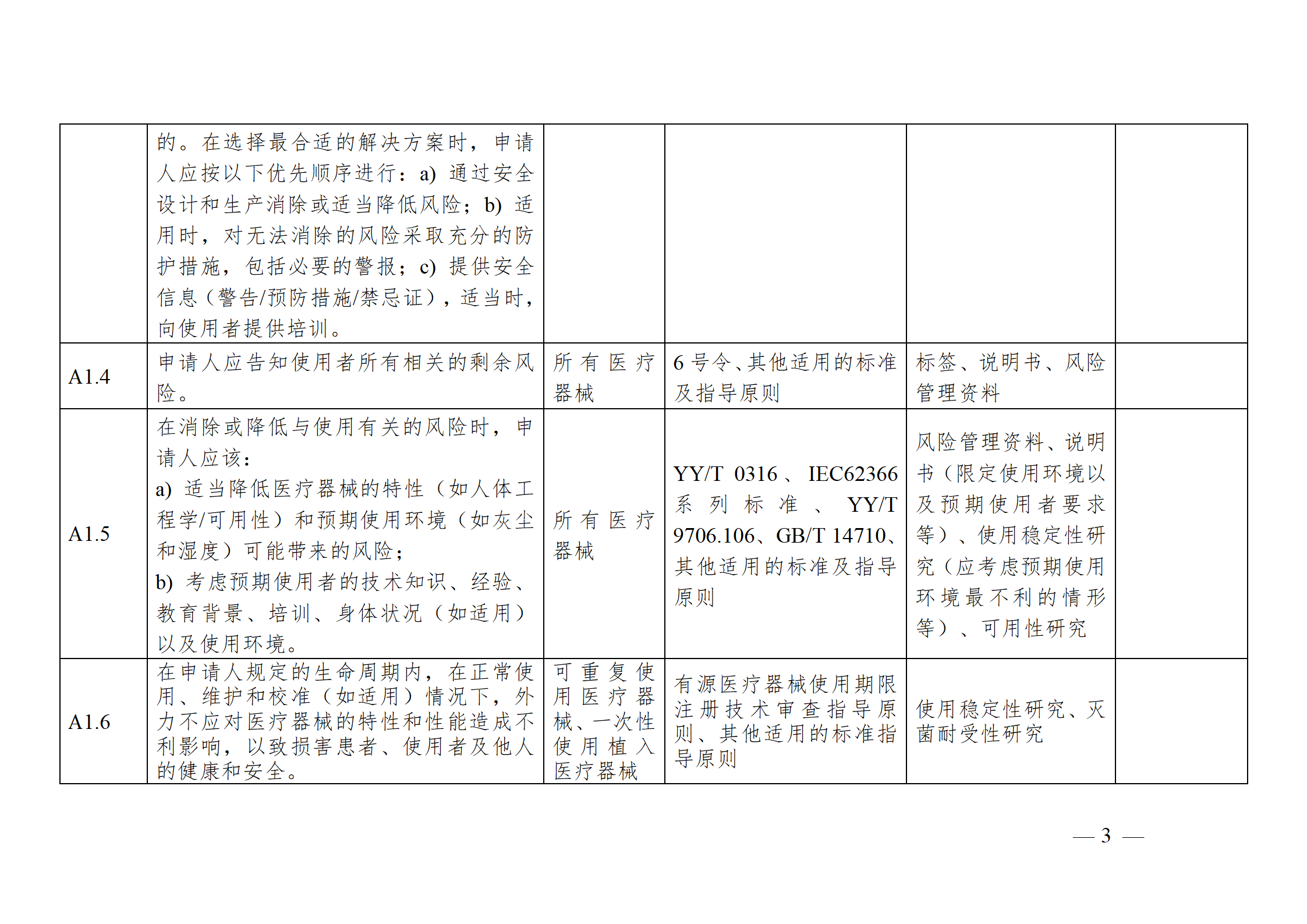
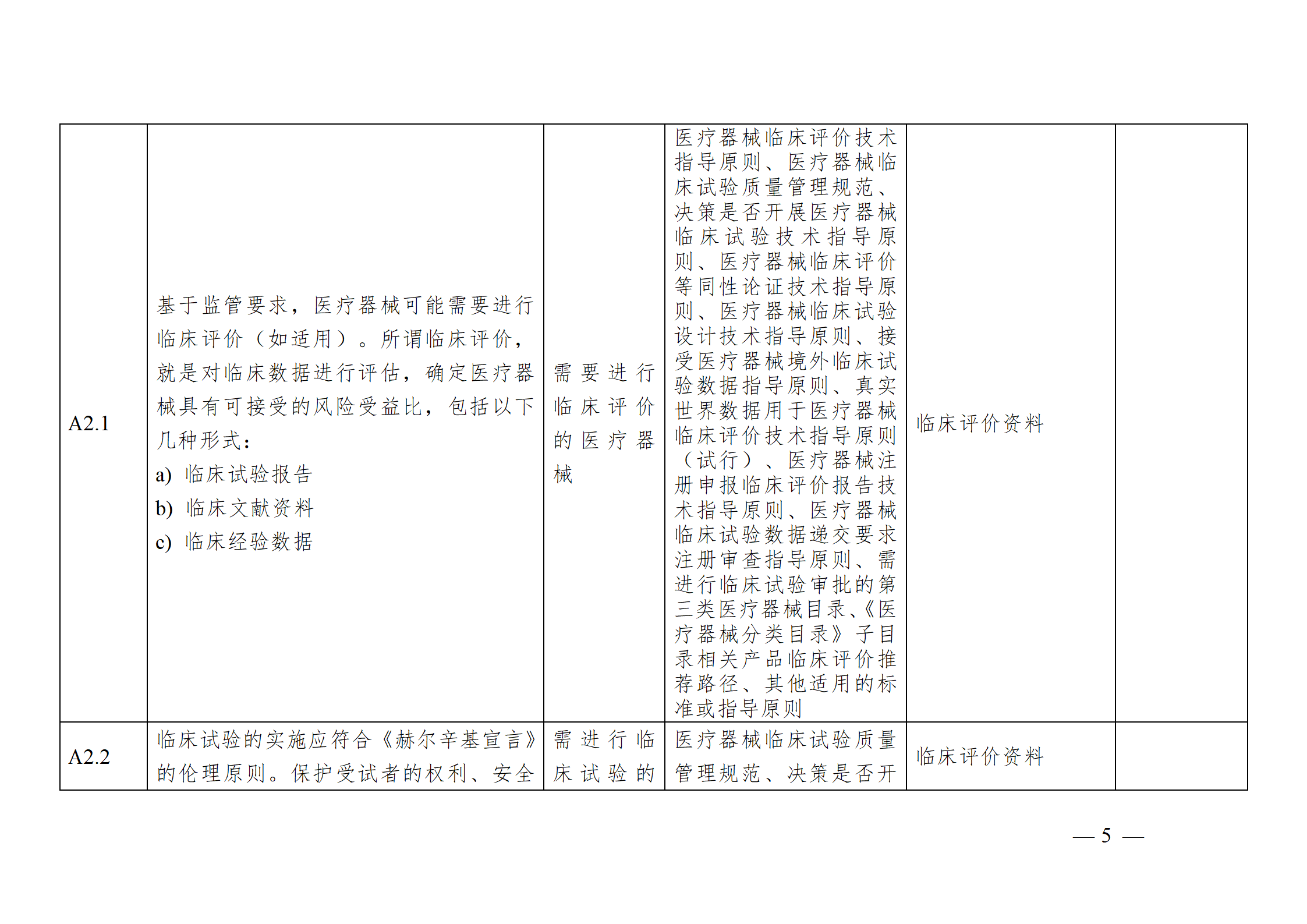
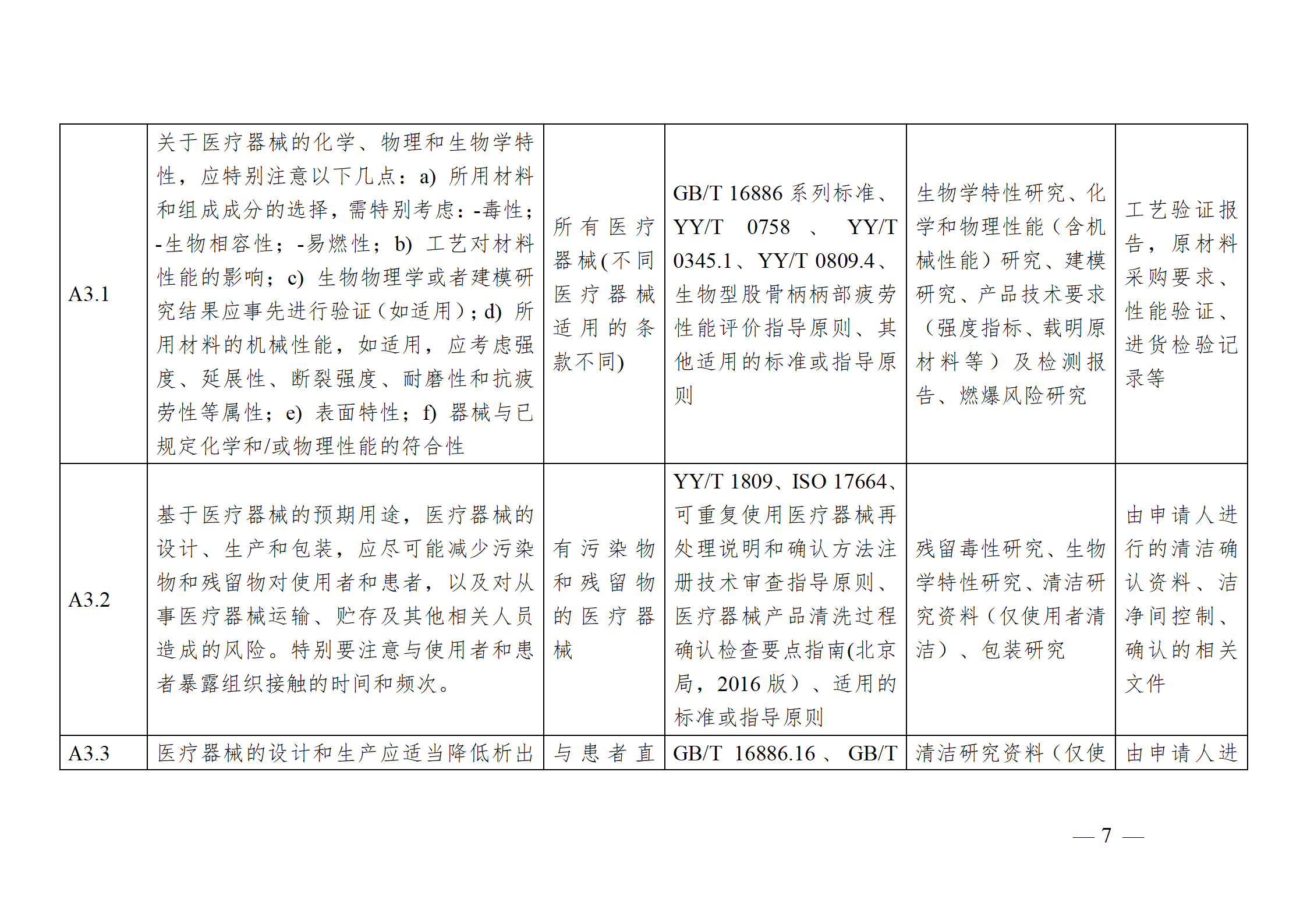
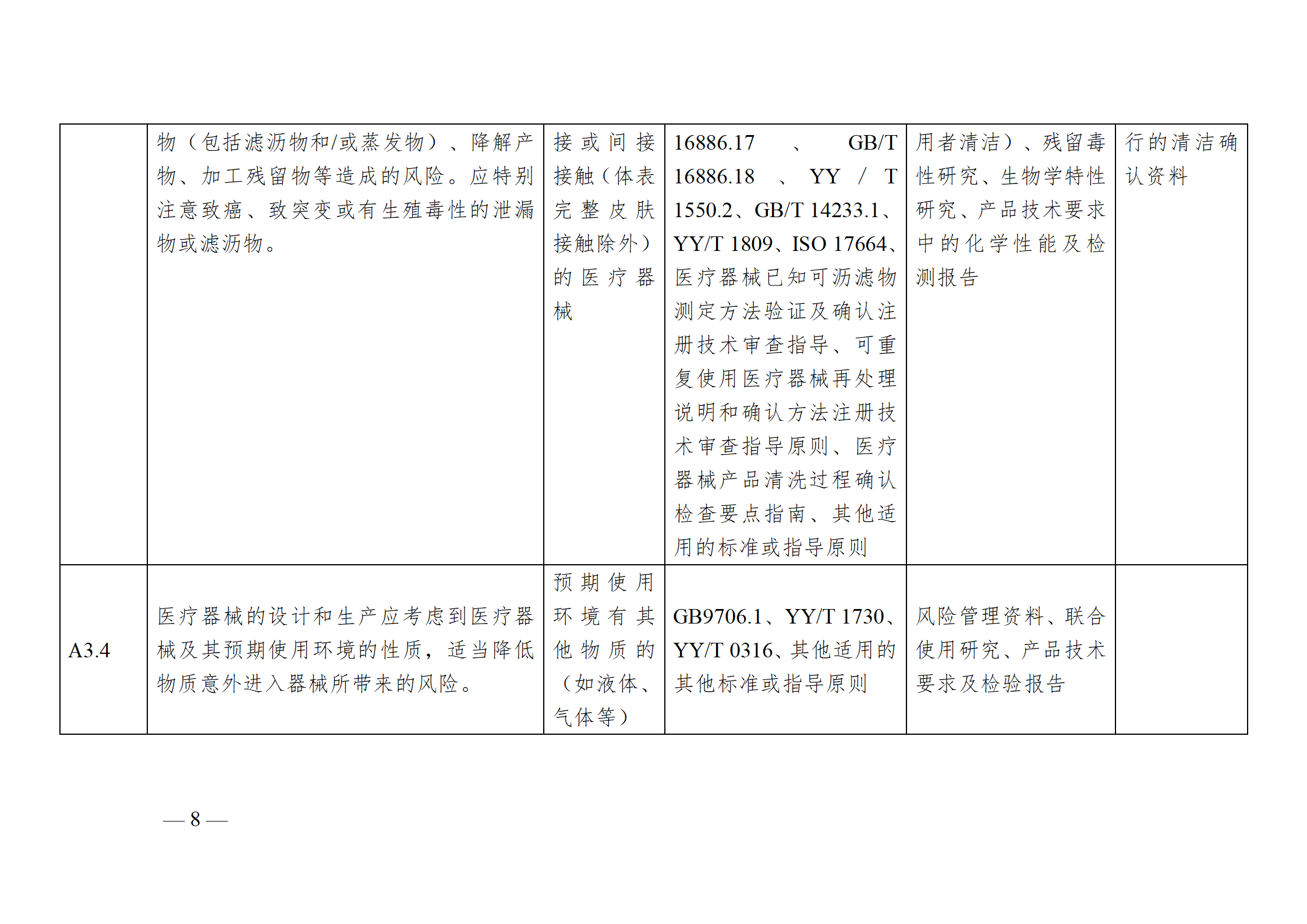
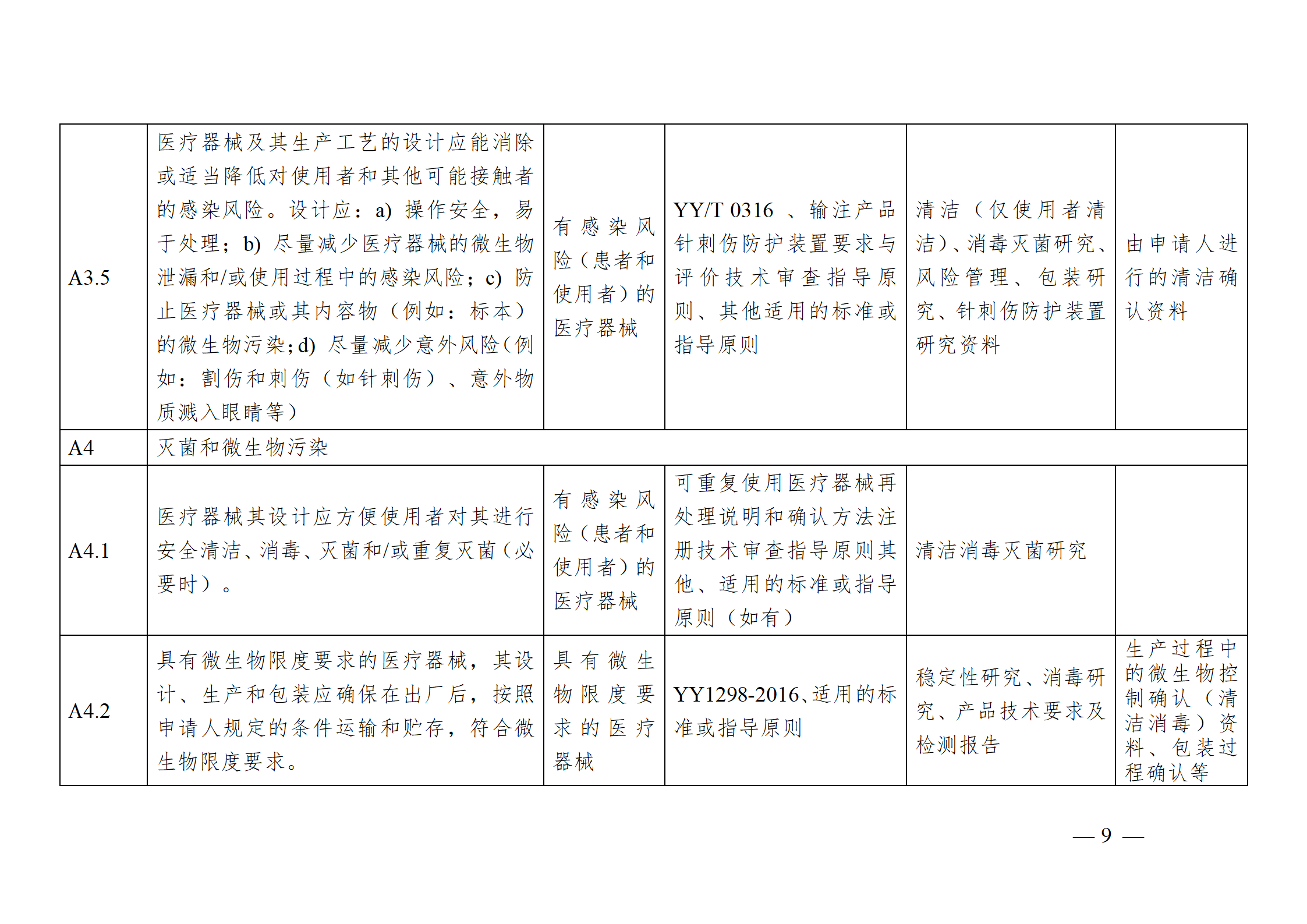
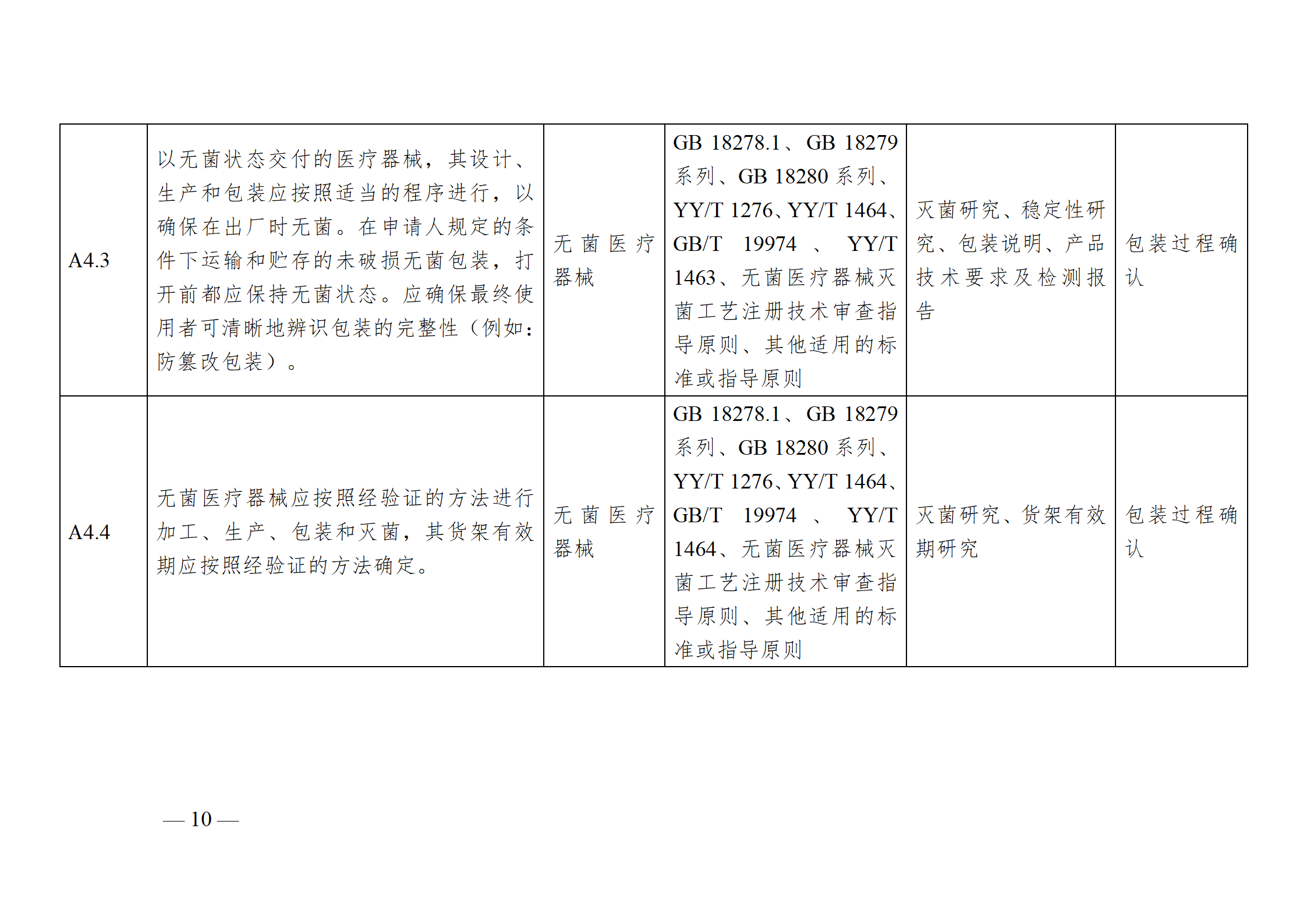
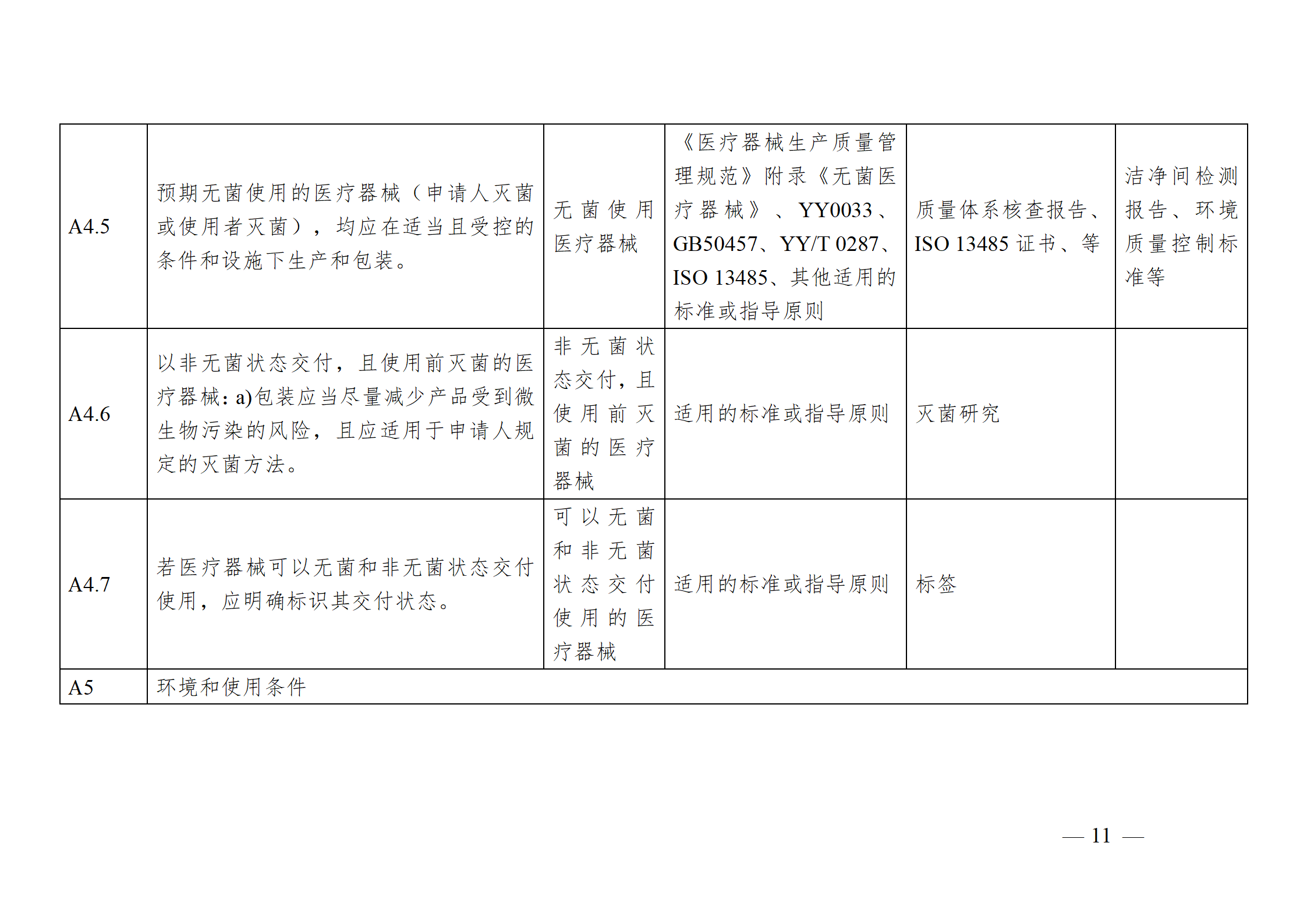
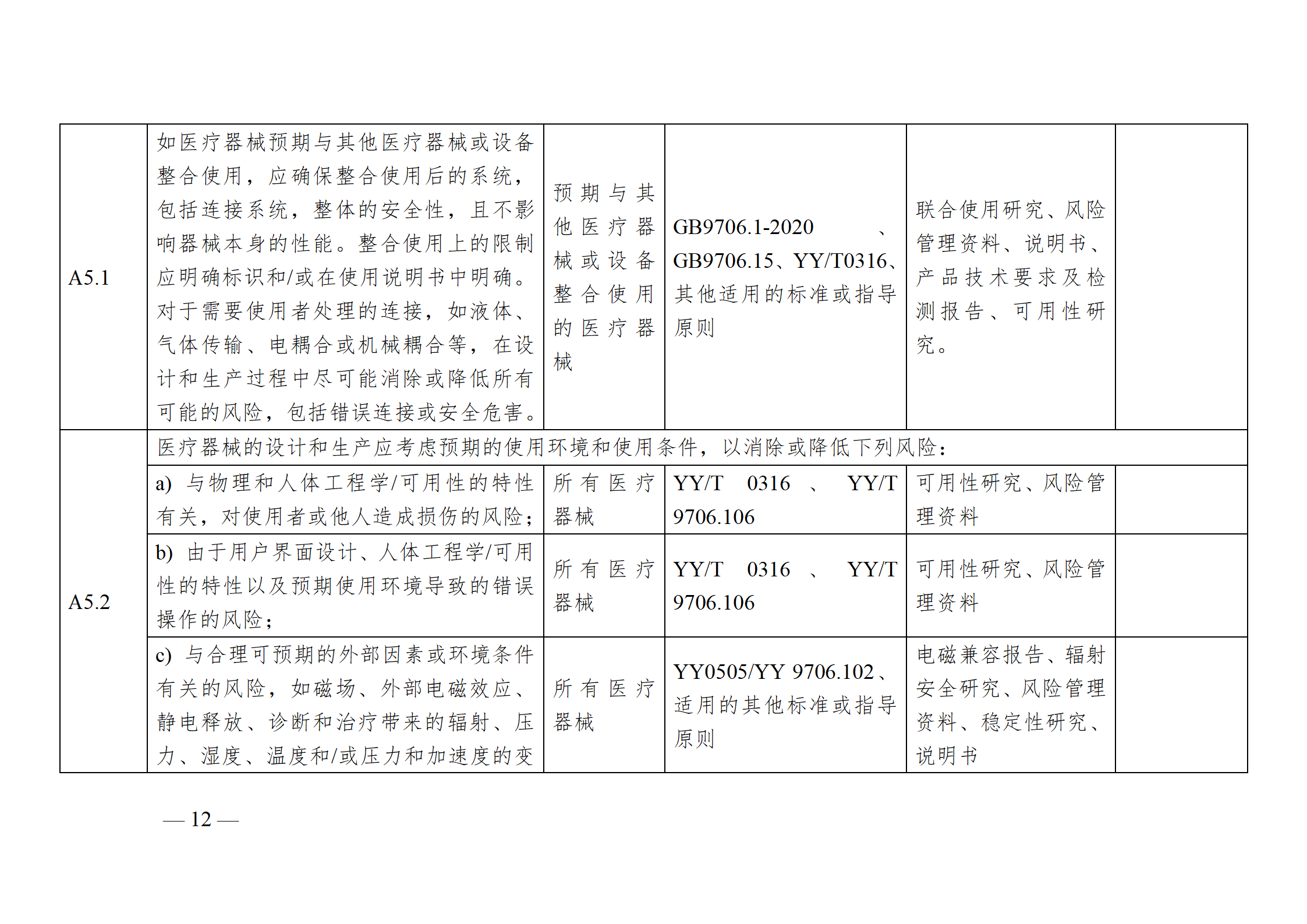
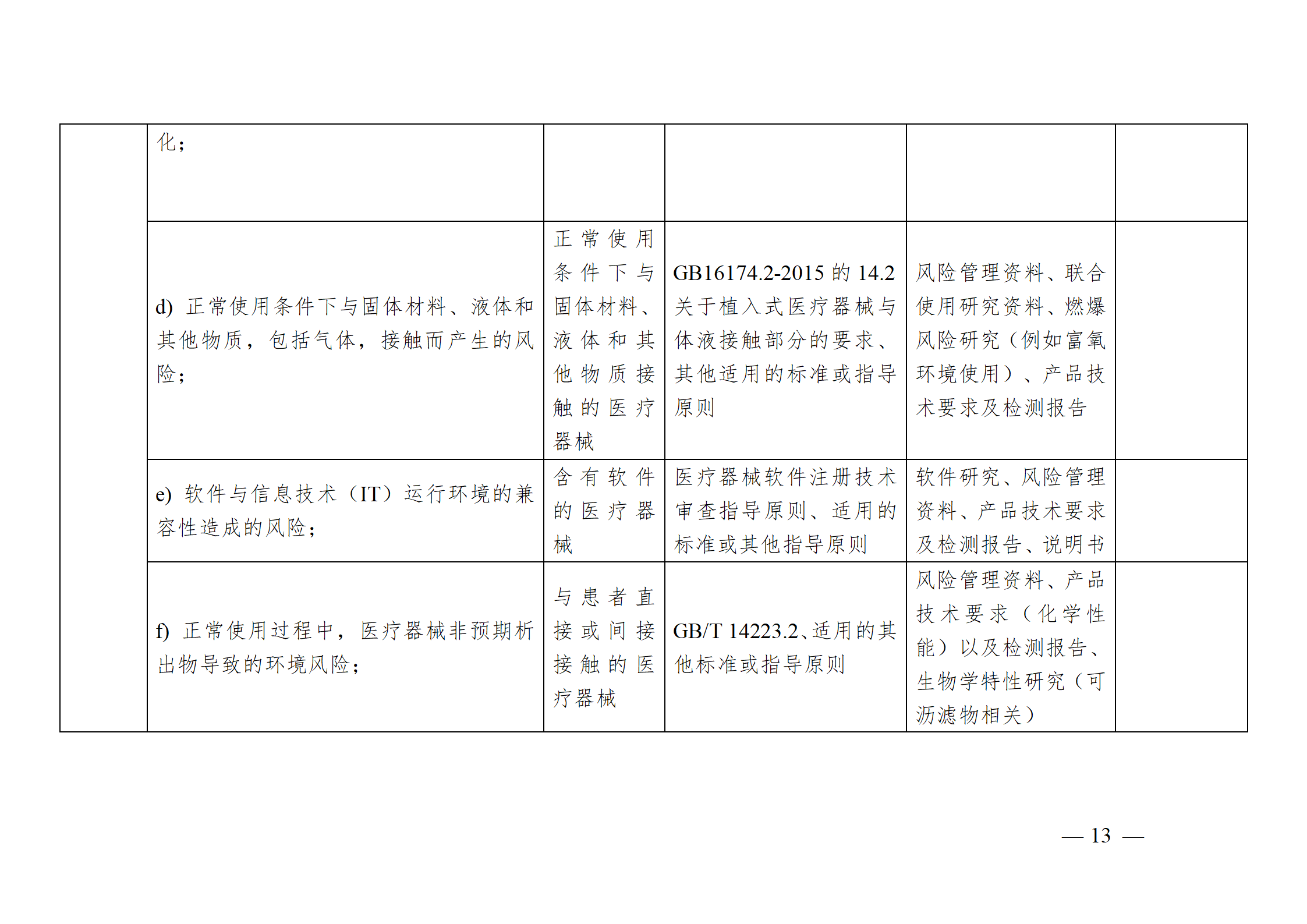
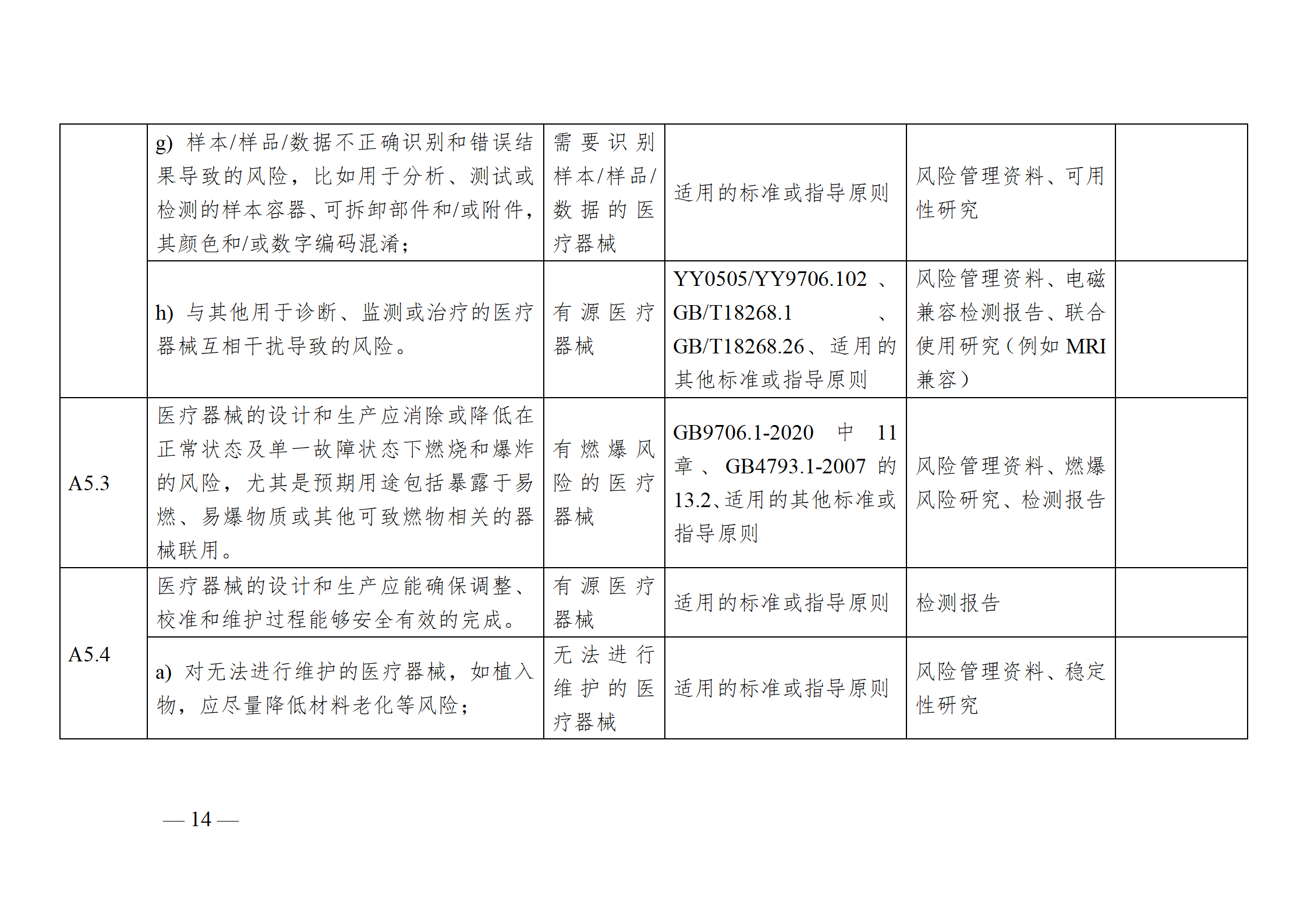
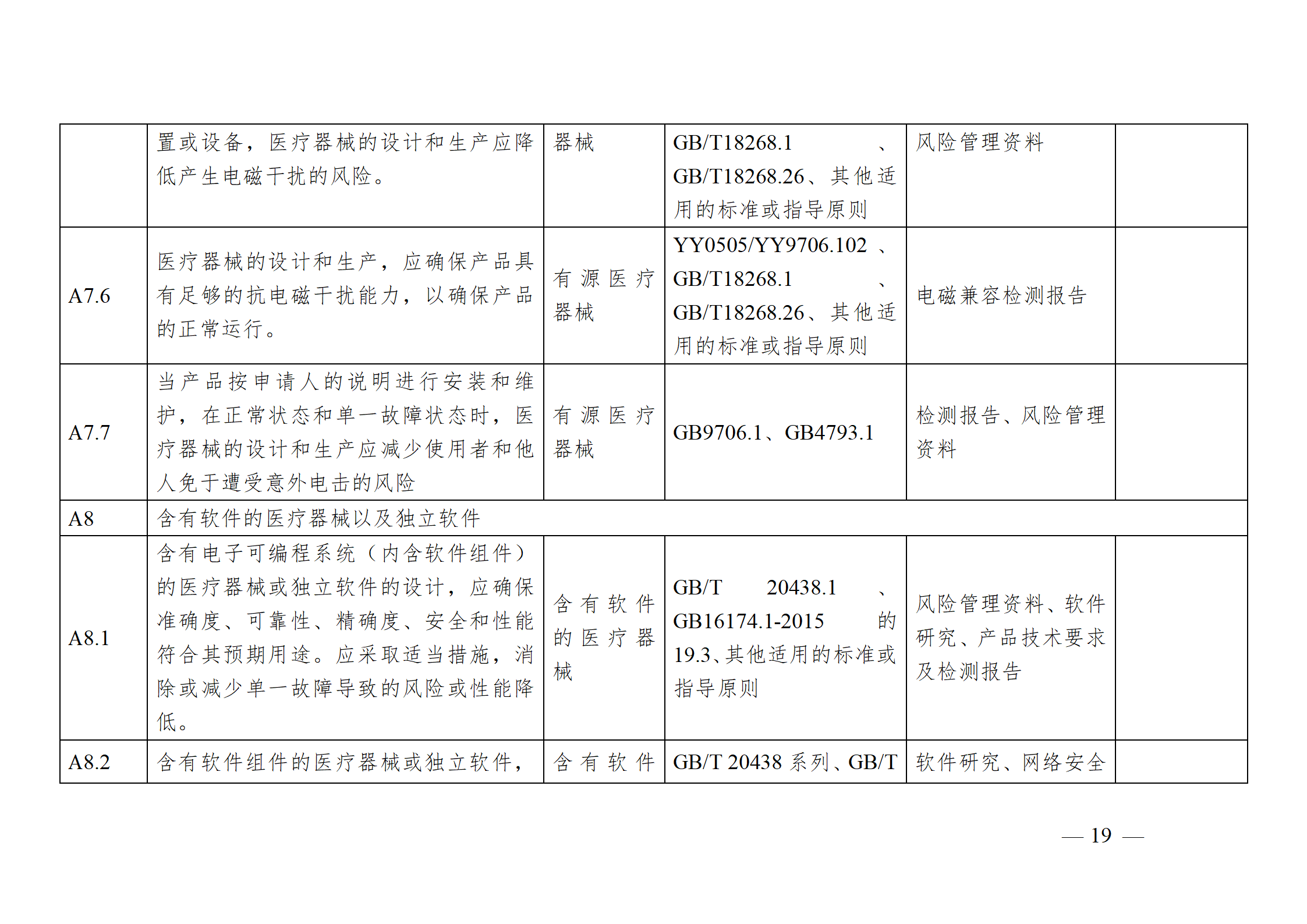
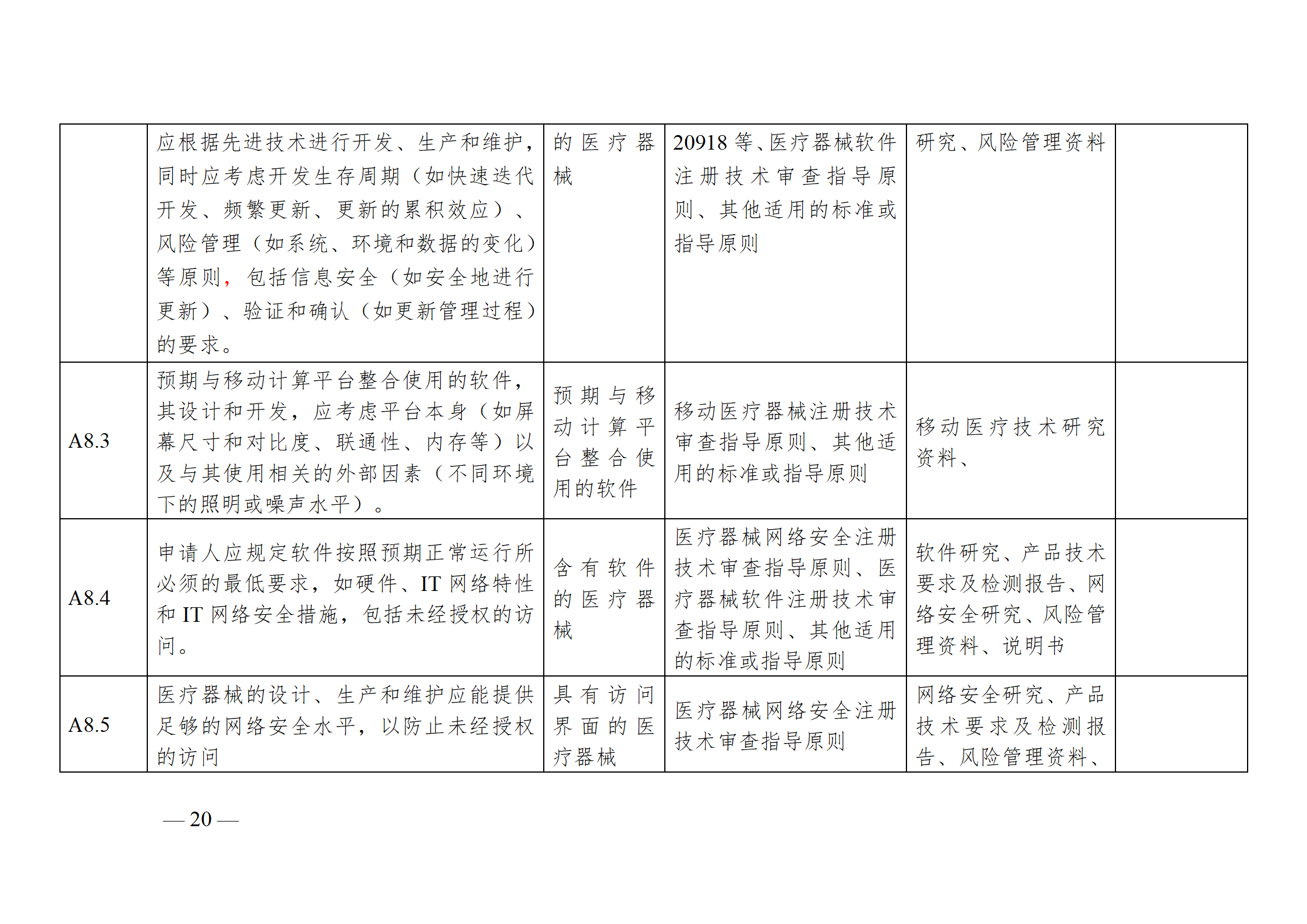
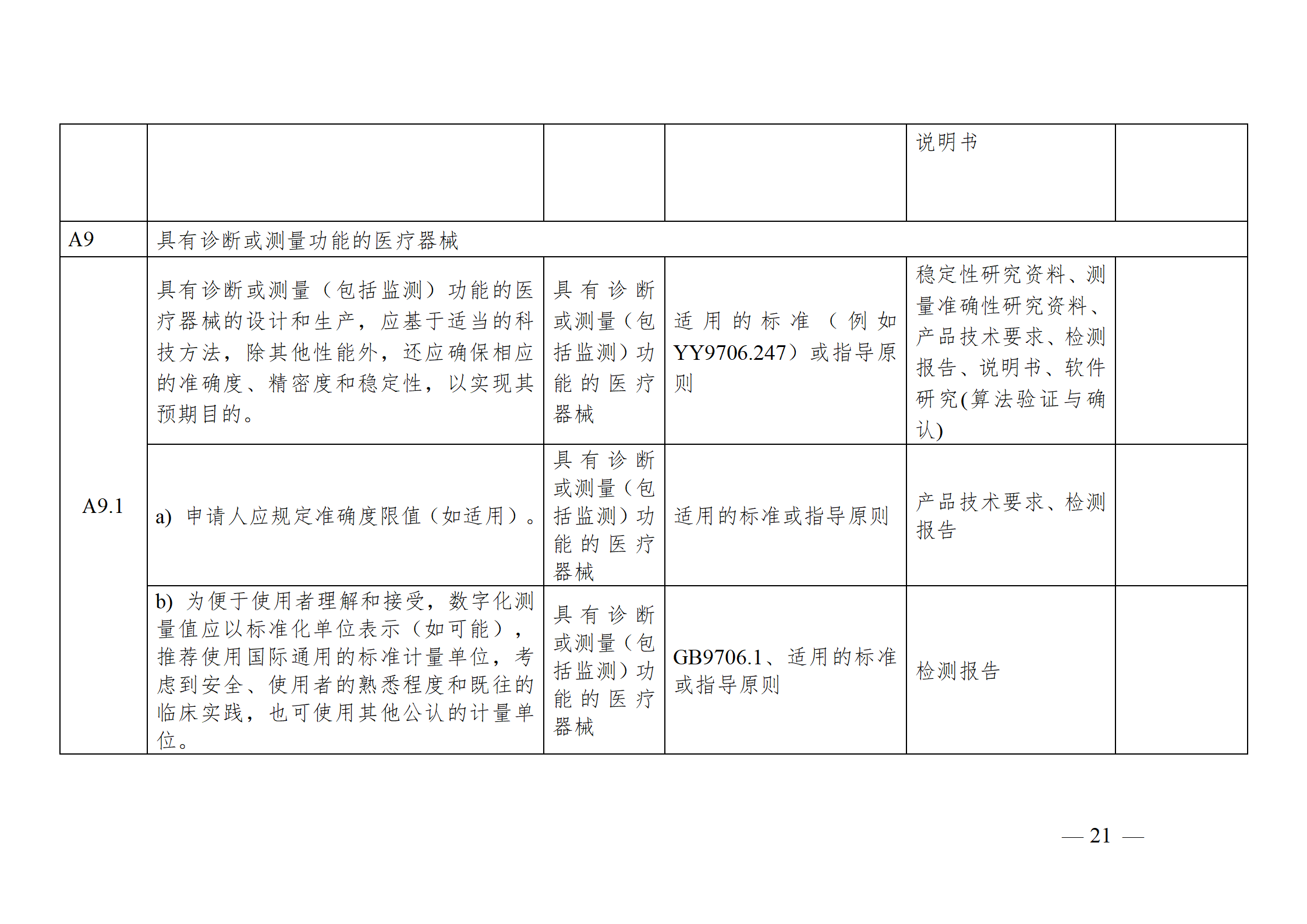
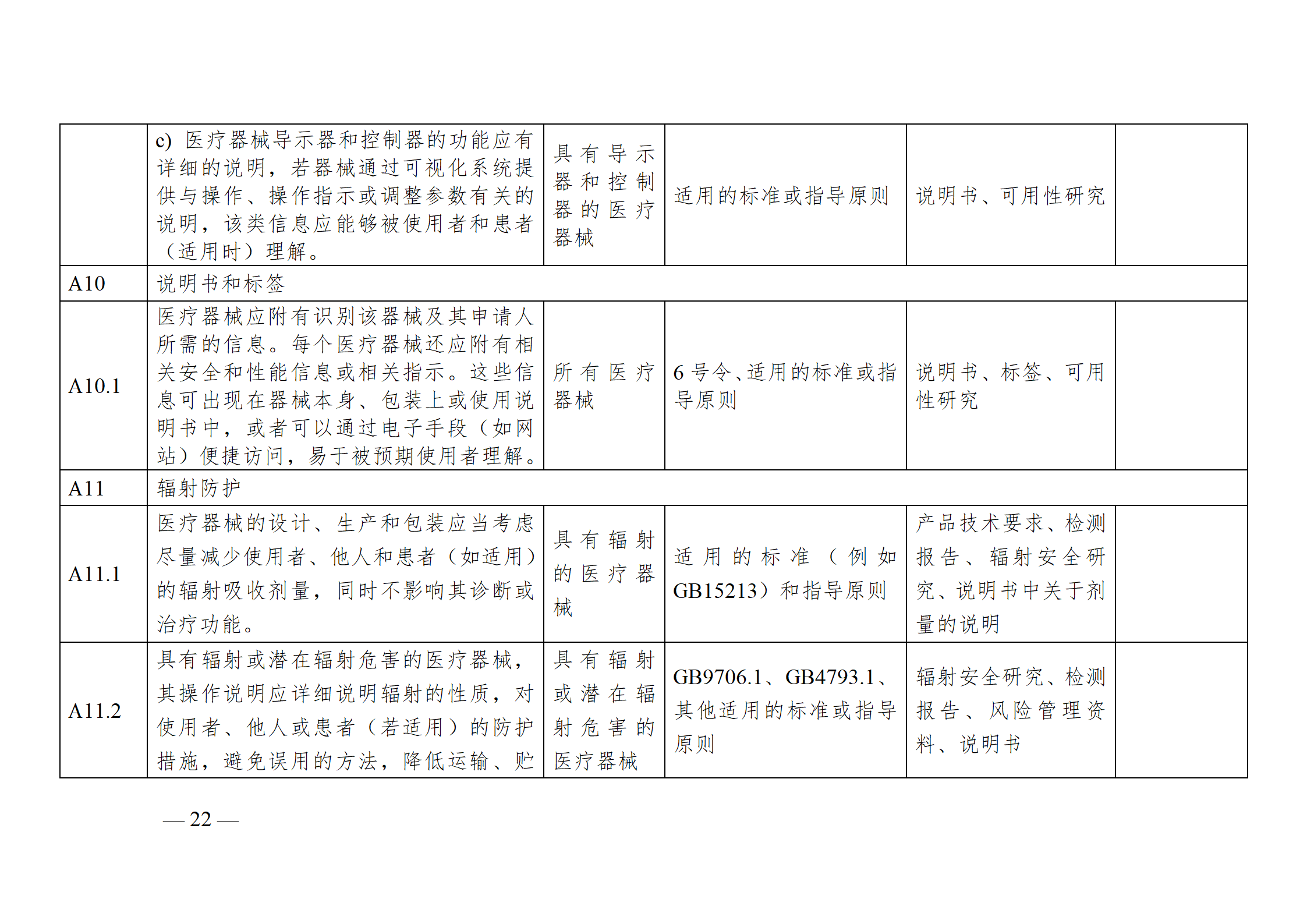
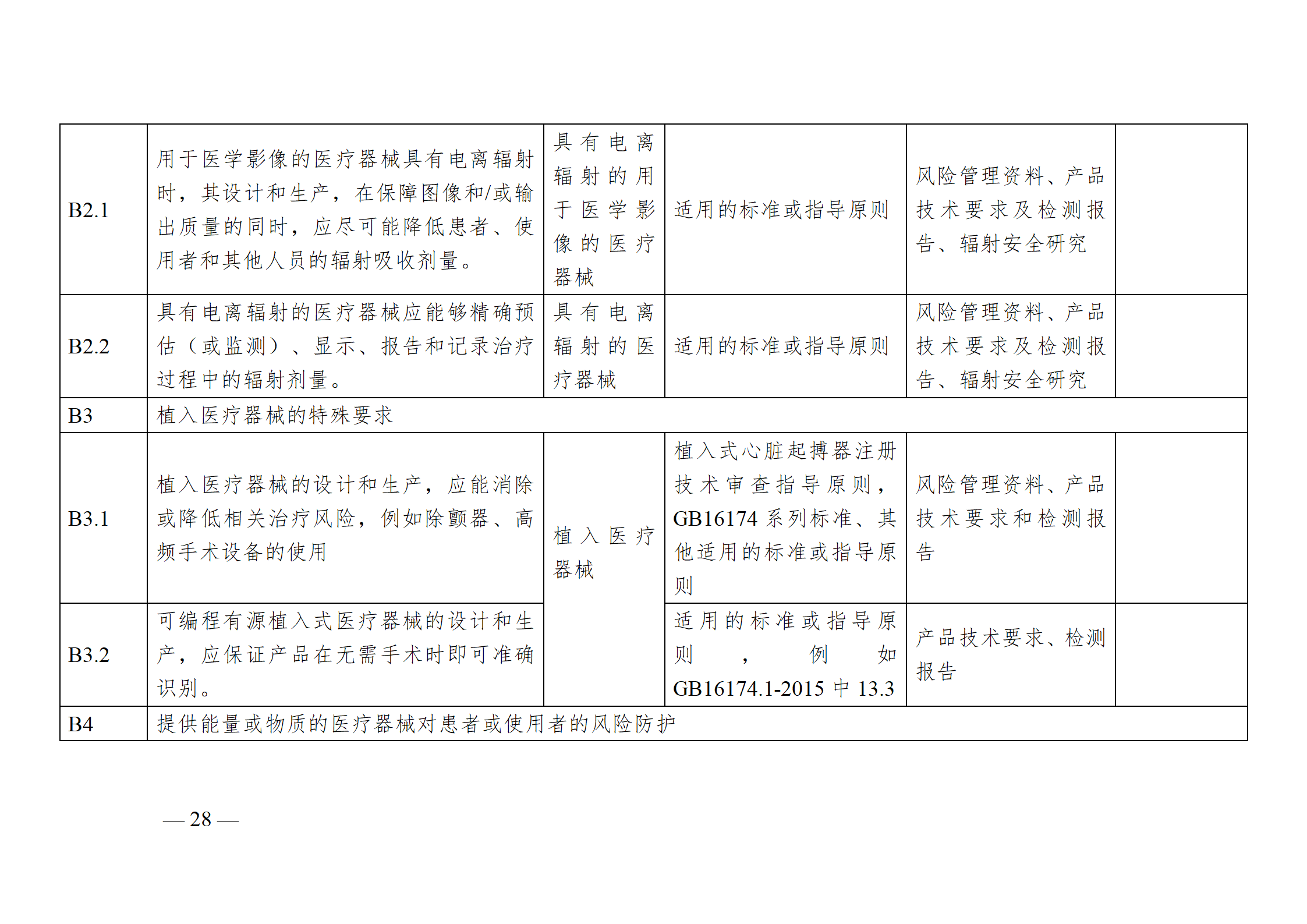
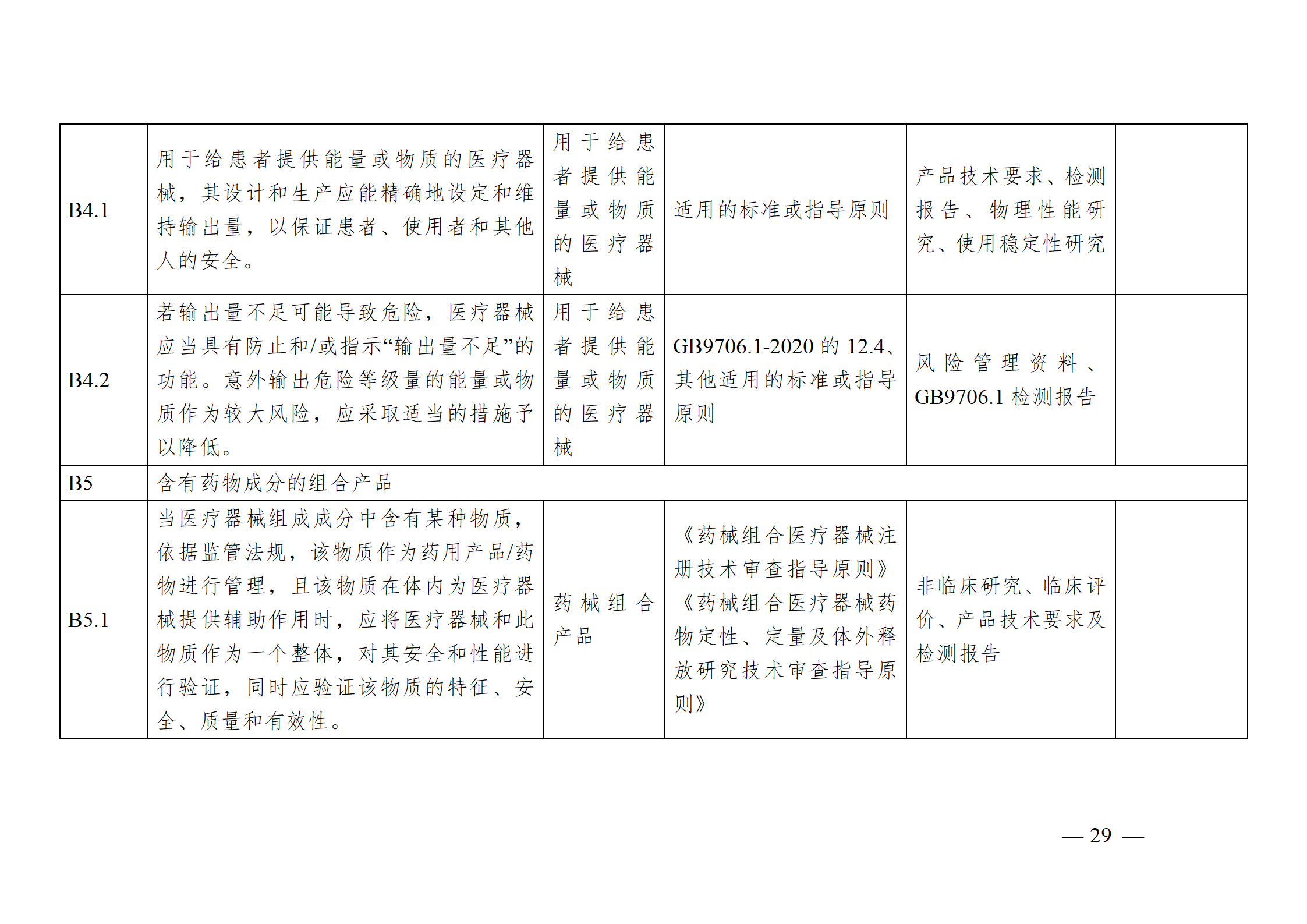
醫療器械安全和性能基本原則符合性技術指南



【附件2】
醫療器械安全和性能基本原則符合性技術指南使用說明
醫療器械直接關系人民群眾生命健康,《醫療器械注冊與備案管理辦法》(國家市場監督管理總局令 第47號)第十三條規定:“醫療器械注冊、備案應當遵守相關法律、法規、規章、強制性標準,遵循醫療器械安全和性能基本原則,參照相關技術指導原則,證明注冊、備案的醫療器械安全、有效、質量可控,保證全過程信息真實、準確、完整和可追溯。”2020年3月,國家藥品監督管理局發布的《醫療器械安全和性能基本原則》(以下簡稱《基本原則》)是基于通用風險提煉出的醫療器械安全有效基本要求,是技術審評決策的重要依據。
為進一步指導注冊申請人科學合理地運用《基本原則》,將《基本原則》的要求高質量地融入產品研發和生產過程中,以確保醫療器械產品的安全有效,并在此基礎上,準確填寫注冊申報資料中的《醫療器械安全和性能基本原則清單》,器審中心通過組織查閱相關法規、標準和指導原則等文件,結合技術審評要求,編寫了《醫療器械安全和性能基本原則符合性技術指南》(以下簡稱《指南》)。《指南》是對所有醫療器械的通用要求,現將有關使用方法說明如下:
一、判斷適用性,確定證明符合性采用的方法
注冊申請人應結合產品特性,根據《指南》中“適用產品”一欄,確定《基本原則》各項具體要求的適用性。對于適用的要求,在產品研發時,可優先參考指南中“證明符合性采用的方法”一欄中給出的可參考的標準或指導原則,也可采用121號公告附件9中說明的方法,包括企業自定的方法、普遍接受的測試方法、與已批準上市的同類產品的比較等。
二、按照確定的方法形成相應的符合性證據
注冊申請人按照確定的證明符合性的方法,在產品研發和生產過程中形成相應的客觀證據。對于每個條款可能涉及的證據,《指南》以“包含在注冊申報資料中的證明符合性的客觀證據”和“不包含在注冊申報資料中的證明符合性的客觀證據”兩欄進行了提示,列出了證據對應的具體申報資料文件名稱。
三、將形成的符合性證據整理形成注冊申報資料
注冊申請人將證明符合性的客觀證據整理形成注冊申報資料(含《醫療器械安全和性能基本原則清單》(以下簡稱《清單》)。證據包含在產品注冊申報資料中,應當在《清單》中說明其在申報資料中的具體位置。證據未包含在產品注冊申報資料中,應當在《清單》中注明該證據文件名稱及其在質量管理體系文件中的編號備查。
《指南》中證明符合性的客觀證據列出了所有醫療器械可能涉及的證據,對于不同的產品,涉及的證據可能不同,并不一定需要《指南》中所列全部證據。《指南》中包含在產品注冊申報資料中的證據涉及可用性研究的,注冊申請人應在質量管理體系控制下,在產品研發過程中開展相應的研究,但目前注冊申報資料不做統一要求。對于可用性研究有明確要求的產品(例如指導原則、審評要點等),需要在注冊申報資料中提交。
《指南》為提供注冊申請人和審查人員使用的指導性文件,不涉及注冊審批等行政事項,亦不作為法規強制執行,如有能夠滿足法規要求的其他方法,也可采用,但應提供詳細的研究資料。本指南是在現行法規體系及當前認知水平下制定的,隨著法規的不斷完善和科學技術的不斷發展,相關內容也將適時進行調整。
【附件下載請掃描下方二維碼】

