2017年,食品藥品監管總局認真貫徹落實《醫療器械監督管理條例》,按照《國務院關于改革藥品醫療器械審評審批制度的意見》(國發〔2015〕44號)、中共中央辦公廳國務院辦公廳《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》(廳字〔2017〕42號),持續深化醫療器械審評審批制度改革,進一步加強對全國醫療器械注冊工作監督和管理,加大注冊現場核查和臨床試驗監督抽查力度,不斷提升醫療器械注冊審評審批的質量與效率。
一、醫療器械注冊工作情況
(一)醫療器械注冊管理法規體系逐步完善
繼續完善醫療器械注冊管理法規體系,配合完成《醫療器械監督管理條例》修正案,發布了《醫療器械標準管理辦法》(國家食品藥品監督管理總局令第33號)、《體外診斷試劑注冊管理辦法修正案》(國家食品藥品監督管理總局令第30號)、《關于調整部分醫療器械行政審批事項審批程序的決定》(國家食品藥品監督管理總局令第32號)、《醫療器械臨床試驗機構條件和備案管理辦法》(國家食品藥品監督管理總局 國家衛生和計劃生育委員公告2017年第145號)、《第三批免于進行臨床試驗醫療器械目錄》(國家食品藥品監管總局通告2017年第130號)。標志著我國醫療器械注冊管理法規體系逐步完善,為醫療器械注冊管理工作提供了制度保障,同時也為醫療器械企業注冊申報工作的有序開展提供了良好的法規基礎。
(二)醫療器械審評審批制度改革持續深入
積極落實醫療器械審評審批改革措施,完善審評審批體系,督促指導改革工作,各項改革任務有序推進。1.持續做好鼓勵醫療器械創新相關改革工作,貫徹實施《關于改革審評審批制度鼓勵藥品醫療器械創新的意見》,組織召開全國醫療器械審評審批制度改革宣貫會,傳達改革精神,解讀改革政策,安排部署重點工作。發布《關于上海市食品藥品監督管理局開展醫療器械注冊人制度試點工作的公告》,推動醫療器械注冊人制度在上海開展試點工作,保證《意見》要求的有效落實。
2.發布《醫療器械審評溝通交流管理辦法(試行)》《關于發布醫療器械技術審評專家咨詢委員會管理辦法的公告》,持續規范醫療器械審評工作,完善溝通交流制度,規范專家咨詢。不斷完善審評質量管理體系和制度文件,繼續推進項目小組審評制度,規范延續注冊的審查要求,提高審評效率。
3.發布《關于調整部分醫療器械行政審批事項審批程序的決定》,將第三類高風險醫療器械臨床試驗審批、境內第三類醫療器械和進口醫療器械延續注冊審批和許可事項變更審批調整至器審中心,進一步簡政放權,減少審批環節,優化審批流程,提升審批效率。
4.成立醫療器械分類技術委員會,建立分類技術專業組。發布新《醫療器械分類目錄》,開展綜合培訓,加強政策解讀,全面宣傳貫徹新《醫療器械分類目錄》,做好目錄實施準備工作。
5.修訂《醫療器械標準制修訂工作管理規范》,細化醫療器械標準制修訂工作程序。組織開展86項醫療器械行業標準制修訂工作,審核發布《醫療器械 質量管理體系 用于法規的要求》等98項醫療器械行業標準。
6.發布《第三批免于進行臨床試驗醫療器械目錄》,對153種第二類醫療器械、11種第三類醫療器械,合計164種醫療器械產品豁免臨床試驗,其中包含116種體外診斷試劑產品,進一步擴大了免于進行臨床試驗的醫療器械目錄范圍,減輕管理相對人負擔。同時配套發布《免于進行臨床試驗體外診斷試劑臨床評價資料基本要求》,指導申請人開展體外診斷試劑臨床評價相關工作。
7.完成過敏原類、流式細胞儀配套用、免疫組化和原位雜交類體外診斷試劑產品屬性及類別調整工作,合理降低有關產品類別,滿足臨床使用需求。
8.臨床試驗監督抽查力度不斷加大。組織2批醫療器械臨床試驗監督檢查,抽取19家企業的19個注冊申請項目,對涉及的38家臨床試驗機構進行檢查, 對3個存在真實性問題的注冊申請,作出不予注冊、自不予注冊之日起一年內不予再次受理的處理決定。共有169家企業主動撤回了261項醫療器械注冊申請。省局開展了第二類醫療器械產品臨床試驗監督抽查。
通過現場監督檢查,強化了醫療器械注冊申請人和臨床試驗機構的法律意識、誠信意識、責任意識和質量意識,有力地規范醫療器械臨床試驗過程,打擊弄虛作假行為,起到了巨大的震懾作用。
(三)加強醫療器械注冊工作監督管理
1.發布《關于做好醫療器械檢驗有關工作的通知》,確保注冊檢驗工作穩定有序。發布《關于進口醫療器械注冊申請人和備案人名稱使用中文的公告》,規范相關工作要求。2.發布了人工耳蝸植入系統、醫用磁共振成像系統、髖關節假體系統等80項醫療器械注冊技術審查指導原則,其中制定52項,修訂28項。針對目前醫療器械發展實際,發布《醫療器械網絡安全注冊技術審查指導原則》《移動醫療器械注冊技術審查指導原則》《醫療器械注冊單元劃分指導原則》,有效地統一了相關審查要求,進一步規范指導相關產業健康發展。
二、醫療器械注冊申請受理情況
2017年,食品藥品監管總局依職責共受理醫療器械注冊、延續注冊和許可事項變更申請6834項,與2016年相比注冊受理項目減少23.4%。
(一)整體情況
受理境內第三類醫療器械注冊申請2457項,受理進口醫療器械注冊申請4377項。按注冊品種區分,醫療器械注冊申請4748項,體外診斷試劑注冊申請2086項。
按注冊形式區分,首次注冊申請1429項,占全部醫療器械注冊申請的20.9%;延續注冊申請3306項,占全部醫療器械注冊申請的48.4%;許可事項變更注冊申請2099項,占全部醫療器械注冊申請的30.7%。注冊形式比例情況見圖1。
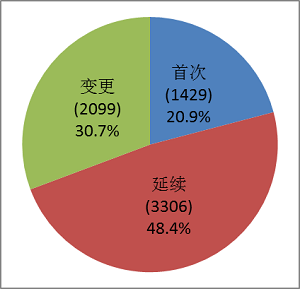
圖1.注冊形式比例圖
(二)分項情況
1.境內第三類醫療器械注冊受理情況境內第三類醫療器械注冊受理共2457項,與2016年相比減少18.3%。其中,醫療器械注冊申請1612項,體外診斷試劑注冊申請845項。
從注冊形式看,首次注冊796項,占全部境內第三類醫療器械注冊申請數量的32.4%;延續注冊1151項,占全部境內第三類醫療器械注冊申請數量的46.8%;許可事項變更510項,占全部境內第三類醫療器械注冊申請數量的20.8%。注冊形式分布情況見圖2。
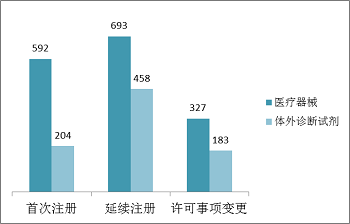
圖2.境內第三類注冊申請注冊形式分布圖
2.進口第二類醫療器械注冊受理情況
進口第二類醫療器械注冊受理共2057項,與2016年相比減少33.5%。其中醫療器械注冊申請1283項,體外診斷試劑注冊申請774項。從注冊形式看,首次注冊331項,占全部進口第二類醫療器械注冊申請數量的16.1%;延續注冊985項,占全部進口第二類醫療器械注冊申請數量的47.9%;許可事項變更741項,占全部進口第二類醫療器械注冊申請數量的36.0%。注冊形式分布情況見圖3。
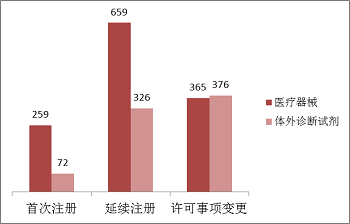
圖3.進口第二類注冊申請注冊形式分布圖
3.進口第三類醫療器械注冊受理情況
進口第三類醫療器械注冊受理共2320項,與2016年相比減少17.7%。其中醫療器械注冊申請1853項,體外診斷試劑注冊申請467項。從注冊形式看,首次注冊302項,占全部進口第三類醫療器械注冊申請數量的13.0%;延續注冊1170項,占全部進口第三類醫療器械注冊申請數量的50.4%;許可事項變更848項,占全部進口第三類醫療器械注冊申請數量的36.6%。注冊形式分布情況見圖4。
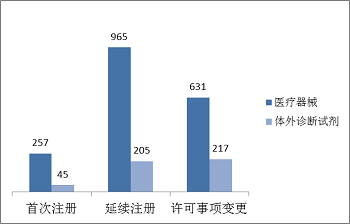
圖4.進口第三類注冊申請注冊形式分布圖
三、醫療器械注冊審評審批情況
2017年,食品藥品監管總局共完成醫療器械注冊申請技術審評8579項,與2016年相比減少8.1% 。其中,首次注冊 1507項,延續注冊5218項,許可事項變更1854項。
2017年,食品藥品監管總局共批準醫療器械注冊、延續注冊和許可事項變更注冊項8923。與2016年相比注冊批準總數量增長3.1%。
2017年,食品藥品監管總局共對223項醫療器械注冊申請不予注冊,企業自行撤回331項。
近五年總局批準醫療器械注冊情況見圖5。
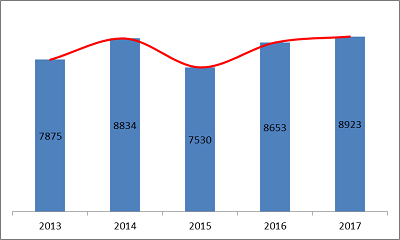
圖5.2013-2017年度注冊數據圖
(一)整體情況
2017年,總局批準境內第三類醫療器械注冊3300項,與2016年相比增加13.7%,進口醫療器械5623項,與2016年相比減少2.3%。
按照注冊品種區分,醫療器械5475項,占全部醫療器械注冊數量的61.4%;體外診斷試劑3178項,占全部醫療器械注冊數量的35.6%。
按照注冊式形區分,首次注冊1379項,占全部醫療器械注冊數量的15.5%;延續注冊5614項,占全部醫療器械注冊數量的62.9%;許可事項變更注冊1930項,占全部醫療器械注冊數量的21.6%。注冊形式比例情況見圖6。
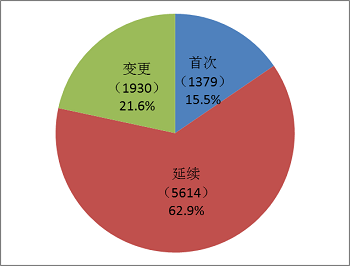
圖6.2017年注冊形式比例圖
(二)分項情況
1.境內第三類醫療器械審評審批情況境內第三類醫療器械注冊3300項。其中,醫療器械1910項,體外診斷試劑1390項。
從注冊形式看,首次注冊813項,占全部境內第三類醫療器械注冊數量的24.6%,延續注冊1941項,占全部境內第三類醫療器械注冊數量的58.8%;許可事項變更546項,占全部境內第三類醫療器械注冊數量的16.5%。注冊形式分布情況見圖7。
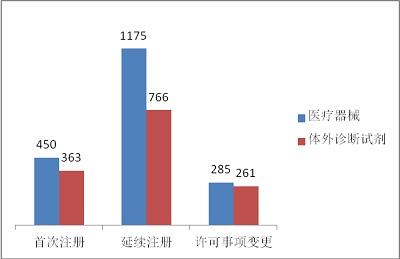
圖7. 境內第三類醫療器械注冊形式分布圖
2.進口第二類醫療器械審評審批情況
進口第二類醫療器械注冊2823項。其中,醫療器械注冊1593項,體外診斷試劑注冊1230項。從注冊形式看,首次注冊375項,占全部進口第二類醫療器械注冊數量的13.3%;延續注冊1769項,占全部進口第二類醫療器械注冊數量的62.6%;許可事項變更679項,占全部進口第二類醫療器械注冊數量的24.1%。注冊形式分布情況見圖8。
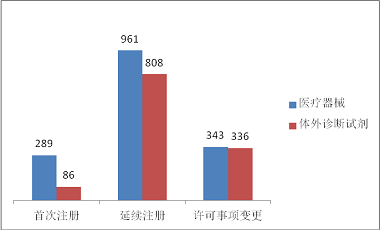
圖8. 進口第二類醫療器械注冊形式分布圖
3.進口第三類醫療器械審評審批情況
進口第三類醫療器械注冊2800項。其中,醫療器械注冊2242項,體外診斷試劑注冊558項。從注冊形式看,首次注冊191項,占全部進口第三類醫療器械注冊數量的6.8%;延續注冊1904項,占全部進口第三類醫療器械注冊數量的68.0%;許可事項變更705項,占全部進口第三類醫療器械注冊數量的25.2%。注冊形式分布情況見圖9。
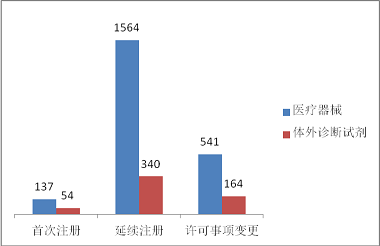
圖9.進口第三類醫療器械注冊形式分布圖
(三)首次注冊項目月度審批情況
2017年,食品藥品監管總局共批準首次注冊醫療器械首次注冊共1379項,月度審批情況見圖10。
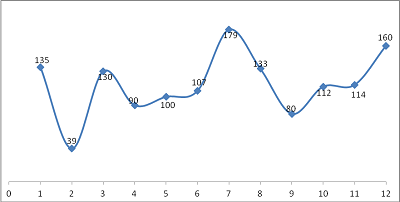
圖10.2017年度月度審批首次注冊醫療器械數據圖
(四)具體批準品種種類分析
2017年,注冊的境內第三類醫療器械,除體外診斷試劑外,共涉及《醫療器械分類目錄》中25個子目錄中產品。注冊數量前五位的境內第三類醫療器械是:醫用高分子材料及制品,植入材料和人工器官,注射穿刺器械,醫用光學器具、儀器及內窺鏡設備,手術室、急救室、診療室設備及器具。
與2016年相比,醫用高分子材料及制品產品增長56.5%,從第二位躍升至第一位,而植入材料和人工器官產品下降10.5%位居第二位,醫用光學器具、儀器及內窺鏡設備和注射穿刺器械產品數量與2016年基本持平,手術室、急救室、診療室設備及器具產品雖增長24.3%,但仍然位居第五位。
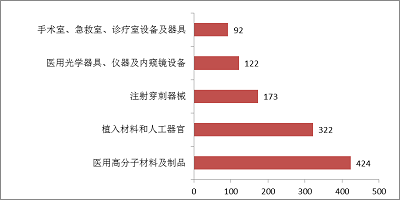
圖11.境內第三類醫療器械注冊品種排位圖
2017年,注冊的進口醫療器械,除體外診斷試劑外,共涉及《醫療器械分類目錄》中40個子目錄中產品。
注冊數量前五位的進口醫療器械,主要是:植入材料和人工器官,醫用光學器具、儀器及內窺鏡設備,口腔科材料,醫用高分子材料及制品,醫用電子儀器設備。
與2016年相比,雖然植入材料和人工器官類產品仍位居第一位,但同比下降5.1%,醫用高分子材料及制品,醫用電子儀器設備均有下降,而口腔科材料產品上升幅度較大,取代了手術室、急救室、診療室設備及器具進入前五位。
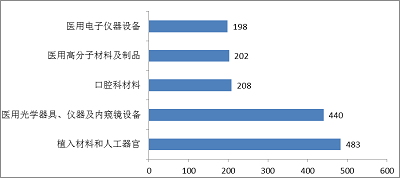
圖12.進口醫療器械注冊品種排位圖
(五)進口醫療器械國別情況
2017年,美國、德國、日本、英國和韓國醫療器械在中國醫療器械注冊數量排前五位,注冊產品數量約占2017年進口產品注冊總數量的73.9%,與2016年基本持平。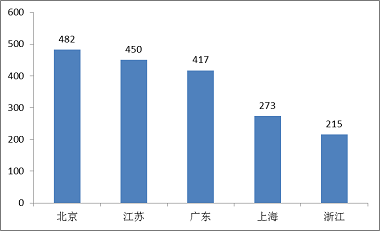
圖13.進口醫療器械國別注冊排位圖
(六)境內第三類醫療器械省份分析
從2017年境內第三類醫療器械注冊情況看,相關注冊產品生產企業主要集中在沿海經濟較發達省份。其中,北京、江蘇、廣東、上海、浙江是境內第三類醫療器械注冊數量排前五名的省份,占2017年境內第三類醫療器械注冊數量的66.7%。
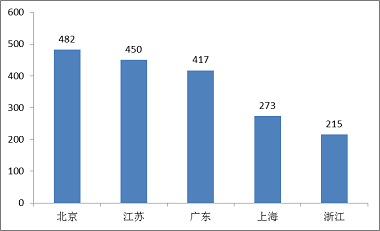
圖14.境內第三類醫療器械注冊省份排位圖
四、創新醫療器械等產品審評審批情況
2017年,食品藥品監管總局按照《創新醫療器械特別審批程序(試行)》,繼續做好創新醫療器械審查工作,并批準了部分創新醫療器械產品上市。
2017年,食品藥品監管總局共收到創新醫療器械特別審批申請273項,完成323項審查(含2016年申請事項),確定63個產品進入創新醫療器械特別審批通道。批準注冊分支型主動脈覆膜支架及輸送系統等12個創新產品上市。其中,有源醫療器械4項,無源醫療器械8項,與2016相比總數增加2項。
這些創新產品核心技術都有我國的發明專利權或者發明專利申請已經國務院專利行政部門公開,產品主要工作原理/作用機理為國內首創,具有顯著的臨床應用價值。
(一)分支型主動脈覆膜支架及輸送系統(國械注準20173463241,上海微創醫療器械(集團)有限公司)。該產品由預裝覆膜支架和輸送系統組成,適用于治療胸主動脈夾層近端破口在左頸總動脈遠端15mm與左鎖骨下動脈(LSA)遠端20mm之間或夾層逆撕至左鎖骨下動脈的患者。該產品的技術屬于國內首創,作為首個批準上市的分支型主動脈覆膜支架,為胸主動脈夾層患者的臨床治療提供了新的治療方法。
(二)折疊式人工玻璃體球囊(國械注準20173223296,廣州衛視博生物科技有限公司)。該產品由球囊、引流管和引流閥組成,由醫用硅橡膠材料制成,適用于嚴重視網膜脫離,不能用現有的玻璃體替代物進行治療的患者。該產品是我國獨立研制的創新產品,屬于國際首創。該產品可長期填充在眼內,解決了玻璃體替代物不能長期停留在眼內、不能長期頂壓視網膜或需反復手術等問題,避免患者眼球摘除和植入義眼座。
(三)經皮介入人工心臟瓣膜系統(國械注準20173460680,杭州啟明醫療器械有限公司)。該產品由主動脈瓣膜、輸送系統組成,適用于經心臟團隊結合評分系統評估后認為患有癥狀的、鈣化的、重度主動脈瓣狹窄,且不適合接受常規外科手術置換瓣膜的患者。該產品是國內首個自膨式經皮介入人工心臟瓣膜,為不適合接受常規外科手術置換瓣膜的患者帶來了顯著的臨床獲益。
(四)一次性可吸收釘皮內吻合器(國械注準20173650874,北京頤合恒瑞醫療科技有限公司)。該產品由可吸收縫合釘和吻合器組成,其中可吸收縫合釘是由L-丙交酯和乙交酯共聚物經注塑而成,適用于腹部手術皮內縫合。該產品的技術屬于國內首創,其臨床應用可在不改變醫生常用的縫合方式前提下,實現閉合速度的提升,利于滲液的排出,且不需拆除縫合釘,為外科手術的術后縫合提供一種新的解決方案。
(五)介入人工生物心臟瓣膜(國械注準20173460698,蘇州杰成醫療科技有限公司)。該產品由自膨脹介入瓣膜、經心尖介入器、瓣膜裝載件組成,適用于經心臟團隊結合評分系統評估后認為不適合進行外科手術的自體主動脈瓣病變患者,包括主動脈瓣狹窄患者、主動脈瓣關閉不全患者。該產品在無需心臟快速起搏的情況下自動定位植入位點,用于主動脈瓣關閉不全患者的治療。該產品的上市將為患有主動脈瓣狹窄患者和主動脈瓣關閉不全患者帶來了顯著的臨床獲益。
(六)左心耳封堵器系統(國械注準20173770881,先健科技(深圳)有限公司)。該產品由左心耳封堵器和輸送器兩部分組成,其中左心耳封堵器由密封盤和固定盤組成。該產品主要用于卒中風險較高且長期口服抗凝治療禁忌或抗凝治療后仍有卒中風險的非瓣膜性房顫患者,可避免或降低左心耳內血栓脫落帶來的卒中風險。該產品作為首個批準上市的國產左心耳封堵產品,為患者提供更多選擇。
(七)腹主動脈覆膜支架系統(國械注準20173461434,北京華脈泰科醫療器械有限公司)。該產品由預裝的覆膜支架及輸送系統組成,適用于腎下腹主動脈瘤和主髂動脈瘤的腔內治療。該產品作為首個批準上市的國產采用帶倒刺裸支架設計的腹主動脈覆膜支架系統,增加了患者的臨床選擇,有效降低了臨床治療成本,減輕了患者的負擔。
(八)全降解鼻竇藥物支架系統(國械注準20173460679,浦易(上海)生物技術有限公司)。該產品由自膨式全降解編織鼻竇支架、藥物涂層、輸送系統和輔助工具組成,適用于慢性鼻竇炎實施功能性內窺鏡鼻竇手術(FESS)患者,防止FESS術后粘連,保持鼻腔通暢,減少炎癥。該產品是境內批準的首例生物可降解鼻竇藥物支架類產品,其上市有助于降低慢性鼻竇炎患者FESS術后復發率,提高患者生活質量。
(九)可變角雙探頭單光子發射計算機斷層成像設備(國械注準20173330681,北京永新醫療設備有限公司)。該產品由主機、檢查床、配電柜、準直器車、采集處理工作站、采集主控工作站組成。用于對神經系統、心血管、腫瘤的核醫學診斷。該產品是國產首臺可變角、全數字化雙探頭臨床通用型SPECT,通過加裝多針孔準直器,無需探頭旋轉即可實現對心臟、甲狀腺等小器官快速高效精準的圖像采集。
(十)低溫冷凍手術系統(國械注準20173583088,海杰亞(北京)醫療器械有限公司)、一次性使用無菌冷凍消融針(國械注準20173583089,海杰亞(北京)醫療器械有限公司)。兩個產品配合使用,組成一個系統。該系統主要由冷凍消融針、傳輸管路、低溫容器、高溫容器、流體電氣控制系統、計算機控制系統以及數據采集系統構成,用于臨床中除空腔腫瘤外的實體腫瘤冷凍治療。該系統采用超低溫冷凍和高強度復溫的復合式治療模式,實現了液氮制冷探針細化技術的突破,通過超低溫冰球對瘤體的包圍殺傷,避免了腫瘤細胞被消融針帶出到正常組織上的隱患,減少了出血的機率。
(十一)植入式心臟起搏器(國械注準20173211570,先健科技(深圳)有限公司)。該產品由植入式脈沖發生器及其附件轉矩扳手組成。適用于治療慢性心律失常。
食品藥品監管總局2017年還批準了部分有較好臨床應用前景的醫療器械產品注冊。如:
(一)藥物洗脫球囊導管(國械注準20173771535,遼寧垠藝生物科技股份有限公司)。該產品為Rx型球囊擴張導管,球囊表面涂有藥物涂層,適用于原發冠狀動脈分叉病變狹窄的擴張。該產品為國際首個批準用于冠狀動脈分叉病變的藥物洗脫球囊導管,為臨床急需的分叉病變治療提供了新的治療策略。
(二)基因測序儀(國械注準20173401605,武漢華大智造科技有限公司)。該產品采用聯合探針錨定聚合測序技術,在臨床上用于對來源于人體樣本的脫氧核糖核酸(DNA)進行測序,以檢測基因序列,這些基因序列變化可能導致疾病或疾病易感性。該儀器在臨床上僅限于與國家食品藥品監督管理部門批準的體外診斷試劑以及軟件配合使用,不用于人類全基因組的測序或從頭測序。
(三)尿中游離巰基檢測試劑盒(生化法)(國械注準20173403176,無錫市申瑞生物制品有限公司)。該產品用于30歲及以上的女性體外定性檢測尿液中游離巰基含量,適合于對宮頸CIN(宮頸上皮細胞不典型增生的)的輔助診斷,CIN分級的確定及腫瘤的確診必須依靠組織學確定,該產品檢測不能作為任何惡性腫瘤的早期診斷或確診依據,不用于普通人群的腫瘤篩查,不能替代宮頸細胞學、陰道鏡及組織病理學檢查。
五、其他注冊管理情況
(一)境內第二類醫療器械注冊情況
2017年,各省級食品藥品監管部門共批準境內第二類醫療器械注冊18582項,與2016年相比增長19.5%。其中首次注冊6605項,延續注冊7436項,許可事項變更注冊4541項。境內第二類醫療器械分項注冊情況見圖15。
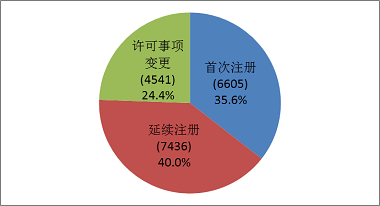
圖15.境內第二類醫療器械注冊形式比例圖
從注冊情況看,江蘇、廣東、浙江、北京、河南、山東、上海七省(直轄市)注冊的境內第二類醫療器械數量較多。第二類醫療器械注冊具體數據見下表及圖16。
地區 | 境內第二類醫療器械注冊 | |||
首次注冊 | 延續注冊 | 許可事項變更 | 總計 | |
北 京 | 482 | 707 | 630 | 1819 |
天 津 | 158 | 170 | 185 | 513 |
河 北 | 283 | 93 | 94 | 470 |
山 西 | 45 | 78 | 15 | 138 |
內蒙古 | 17 | 12 | 1 | 30 |
遼 寧 | 84 | 153 | 58 | 295 |
吉 林 | 191 | 170 | 39 | 400 |
黑龍江 | 39 | 55 | 18 | 112 |
上 海 | 211 | 586 | 92 | 889 |
江 蘇 | 1301 | 1270 | 675 | 3246 |
浙 江 | 619 | 700 | 636 | 1955 |
安 徽 | 59 | 139 | 157 | 355 |
福 建 | 52 | 182 | 61 | 295 |
江 西 | 87 | 195 | 28 | 310 |
山 東 | 636 | 361 | 203 | 1200 |
河 南 | 365 | 757 | 222 | 1344 |
湖 北 | 102 | 201 | 141 | 444 |
湖 南 | 245 | 117 | 119 | 481 |
廣 東 | 1146 | 919 | 719 | 2784 |
廣 西 | 112 | 114 | 38 | 264 |
海 南 | 3 | 7 | 1 | 11 |
重 慶 | 104 | 109 | 48 | 261 |
四 川 | 82 | 200 | 323 | 605 |
貴 州 | 48 | 15 | 4 | 67 |
云 南 | 24 | 24 | 6 | 54 |
西 藏 | 3 | 0 | 0 | 3 |
陜 西 | 65 | 66 | 11 | 142 |
甘 肅 | 20 | 17 | 16 | 53 |
青 海 | 5 | 0 | 0 | 5 |
寧 夏 | 1 | 3 | 1 | 5 |
新 疆 | 16 | 16 | 0 | 32 |
總 計 | 6605 | 7436 | 4541 | 18582 |
圖16.各省境內第二類醫療器械注冊數據圖
(二)第一類醫療器械備案情況
2017年,食品藥品監管總局依職責共辦理進口第一類醫療器械備案數量2315項,與2016年相比減少7.8%。全國設區的市級食品藥品監管部門依職責共辦理境內第一類醫療器械備案數量13203項,與2016年相比增長15.2%。
(三)登記事項變更情況
2017年,食品藥品監管總局依職責共辦理進口第二、三類和境內第三類醫療器械登記事項變更5181項。與2016年相比減少26.8%。
其中,境內第三類醫療器械登記事項變更2100項,進口第二類、三類醫療器械登記事項變更3081項。
各省級食品藥品監管部門依職責共辦理境內第二類醫療器械登記事項變更6326項,與2016年相比減少13.6%。
注:本報告的數據統計自2017年1月1日至2017年12月31日。
