依據《體外診斷試劑注冊備案管理辦法》及其相關文件規定,新冠抗原檢測試劑在臨床試驗及注冊提交前應先完成檢測,檢測樣品可由企業自行送檢且現場辦理檢測流程,中國食品藥品檢定研究院(NIFDC)的新冠抗原檢測試劑的送檢流具體流程如下:
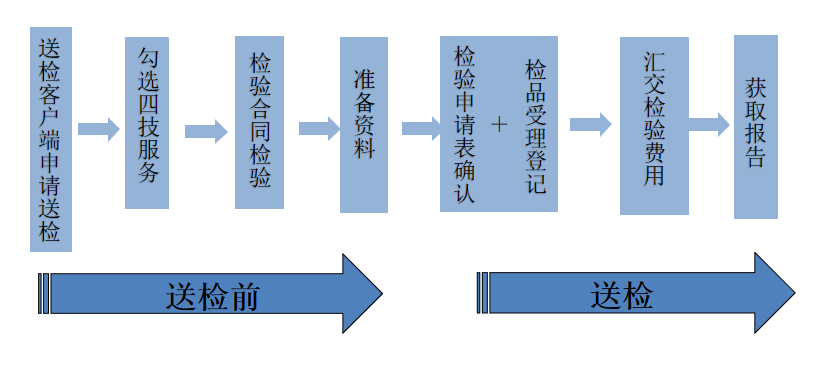
冠抗原檢測試劑注冊現在可以委托有資質的檢測所進行檢測。以下為送檢資料準備和送檢要求,詳細送檢要求企業可在送檢前咨詢樣品送檢檢測所。
1、新冠抗原試劑首次注冊檢驗至少提交以下資料:
(1)申請單位出具的檢驗申請函,加蓋申請單位公章;檢驗申請表(請登記聯系人電話和E-mail信息);
(2)證明文件:申請人企業許可證(復印件),提交資料真實性的聲明。
(3)產品說明書;
(4)擬定申報產品技術要求;
(5)分析性能評估資料;
(6)陽性判斷值確認資料;
(7)自檢報告;
2、新冠抗原試劑注冊檢驗對樣品的要求
(1)樣品數量要求:一般情況下,樣品數量應為一次檢驗用量的三倍。新冠抗原檢測試劑請按照三倍檢驗量(3x60人份)送樣(每批次),以最小包裝計算。如最小包裝為25人份/盒,則單次檢驗量為3盒=75人份,三倍檢驗量為9盒,以此類推。
(2)樣品狀態要求:樣品應包裝完整,有說明書和完整標簽,標簽內容應符合國家局體外診斷試劑標簽說明書相關文件規定,無正規標簽的樣品,必需貼有臨時標簽。標簽內容至少包括:檢品名稱、批號、規格、生產單位;已確定效期的樣品標簽上應注明效期,有特殊儲存條件要求的,標簽上需注明儲存條件。樣品標簽內容必須與資料相應內容一致。
國內新冠抗原試劑盒由可以由企業自行送檢,樣品應封簽完整無損,簽名或蓋章清晰可辨。
(3)樣品效期要求:樣品效期一般應滿足2個檢驗周期,除特殊情況外(如進行穩定性考察),已過效期或效期內不能滿足2個檢驗周期的樣品不予受理。
3、送檢登記注意事項
(1)送檢時請攜帶一式四份(最少)合同。
(2)送樣辦理檢驗申請手續的人員需詳知送檢目的,熟悉樣品特性,了解資料內容及新冠抗原試劑注冊有關規定,能正確填寫檢驗申請表,能對填寫的內容負責。在受理登記后核對申請檢驗登記表各項內容,確認無誤后簽字或蓋章,同時索要檢品受理回執并妥善保存,以作為查詢、領取報告的憑證。
新冠抗原注冊臨床試驗,請聯系:張經理
杭州:135 8840 4338(同微信)
北京:150 1020 1703(同微信)
