截止2022年9月,已有11個省份對醫療器械注冊證轉移政策發布了詳細的法規政策及解讀,本文匯總了各省醫療器械注冊證遷入條件、簡化流程及審批時限。
了解更多醫療器械注冊快捷程序,請聯系瑞旭集團醫療器械法規專家0571-87206527 或010-63984062。
省份 | 遷入條件(政策鏈接后附) | 注冊審批周期 |
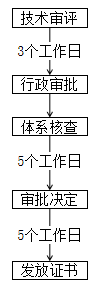
天津 | 境內: ① 外省市企業應在我市成立醫療器械生產企業(以下簡稱:入津企業),入津企業負責申報辦理相關許可事項; ② 外省市企業擬遷入我市產品為在外省市已獲準注冊的第二類醫療器械產品或已取得進口醫療器械注冊證書的產品,同時符合我市醫療器械“鼓勵清單”品種。 ③ “鼓勵清單”如下:
境外: ① 境外醫療器械產品(以下簡稱“境外產品”)為國內按照第二類醫療器械管理的產品,同時符合我市醫療器械“鼓勵清單”品種; ② 已取得國內進口醫療器械注冊證書的產品;尚未取得國內進口醫療器械注冊證書,但在境外已獲準上市的產品; ③ 境外企業應指定我市企業法人作為其產品的注冊申請人,負責申報辦理產品入津注冊事項。境內企業持有境外獲準上市產品的適用本通知,應由境內企業自行申報產品注冊。 |
境內:
境外:
|
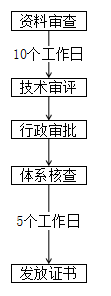
河南 | ① 境內已注冊第二類醫療器械品種因產業轉移至我省,產品無實質改變、符合現行強制性標準,且注冊檢驗合格的,申報注冊時可采用原注冊資料; ② 在我省具備生產條件且產品檢驗合格的,采信原審評審批意見,合并審批生產許可和產品注冊。 | - |
湖南 | ① 外省關聯企業(與省內企業為同一法人、同一集團控股)在境內已注冊的第二類醫療器械來湘申報注冊的,產品無任何改變,管理體系符合要求,且產品檢驗合格的前提下,原則上認可原有的研究資料及注冊信息。 ② 外省關聯企業已完成研發尚未注冊的第二類醫療器械來湘申報注冊的,其研究過程及其結果符合注冊要求,可提交已完成的研究資料。 | 技術審評縮減至5個工作日 |
山東 | 同一集團企業在境內已注冊第二類醫療器械來魯申報的,將原審評審批結論作為重要參考,加快核發醫療器械產品注冊證和醫療器械生產許可證。 | - |
廣東 | 支持已上市進口產品和省外產品遷入我省注冊。 境外醫療器械注冊人以獨資、合資或者合作方式在我省設立的企業,以及跨省兼并、重組或屬同一集團的省內企業(產品不發生實質性變化),進行第二類醫療器械注冊申報時,可使用原產品注冊時的有關申報材料。 | 原則上技術審評時限不超過5個工作日;質量管理體系核查時間另計 |
湖北 | 對外省關聯企業在境內已注冊的第二類醫療器械來鄂申報注冊,產品無實質改變、符合現行法律法規及強制性標準,完成工藝驗證且注冊檢驗合格的,申報注冊時可采用原注冊資料,符合要求的,采信原審評審批意見,合并審批產品注冊和生產許可。 | 原則上審評時限不超過5個工作日,質量管理體系核查時間另計。 |
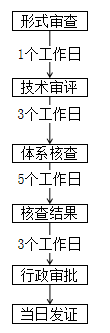
江蘇 | ① 與已取得第二類醫療器械注冊證的注冊人隸屬于同一集團。 ② 擬申報產品與同一集團已取得的注冊證產品為同一品種器械,并在江蘇境內生產。 ③ 根據現行的醫療器械分類目錄、產品注冊指導原則及有關分類界定文件,擬申報產品明確未第二類醫療器械。 ④ 注冊申請人應為省內醫療器械生產企業。 ⑤ 擬申報產品為首次按照同一集團來蘇注冊程序進行申報的。如該產品存在因審批決定不予注冊或注冊申請人自行撤審的情形,該產品再次申報注冊時按照常規程序開展審評審批。 | 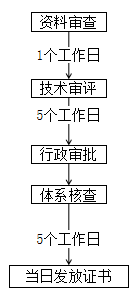 |
貴州 | 已在外省市取得產品注冊證醫療器械生產企業,攜已注冊產品遷入本省生產的,在我省申請此類產品首次注冊時,除產品檢驗報告、生物相容性等研究性試驗資料外,可使用原產品注冊時的有關申報材料。 | - |
遼寧 | 鼓勵外省企業通過兼并、重組、資產注入、集團內轉移、同一法人投資等方式,將已上市的第二類醫療器械轉移至我省注冊生產。符合上述情形的申請人,應當在申請注冊時一并提交情況說明及證明材料,注冊資料可使用原注冊的相關內容。 | 按照遼寧省第二類醫療器械優先注冊時限辦理(原則上不超過20個工作日) |
云南 | 加快集團內轉移品種審評審批速度,對同一集團企業在境內已注冊的第二類醫療器械來我省申請注冊的,優化審評審批流程,將原審評審批結論作為重要參考,提速醫療器械產品注冊證和醫療器械生產許可證核發。 | - |
江西 | ① 申請人與已取得第二類醫療器械注冊證的注冊人隸屬于同一集團或同一法人。 ② 已取得的第二類醫療器械注冊證必須符合現行法規規章要求。 ③ 擬申報產品與已取得的注冊證產品為同一品種醫療器械,不發生實質變化,并在我省境內生產。 ④ 注冊申請人應為省內醫療器械生產企業。 |
|
除本文所寫受理條件以及資料準備,企業在進行注冊證遷移時,最好向遷入省份進行電話溝通確認,注冊檢測報告、產品技術要求等較為重要文件是否允許資料互認。 | ||
各省醫療器械注冊證遷入簡化政策鏈接
省份名稱 | 法規名稱 | 發布日期 | 查詢路徑 |
天津 | 天津市藥品監督管理局 關于印發天津市第二類醫療器械優先審批程序的通知 | 2019-11-10 | 天津市市場監督管理委員會 |
天津市藥品監督管理局關于簡化外省市醫療器械企業產品遷入我市相關審批工作的通知 | 2020-01-31 | 天津市藥品監督管理局 | |
天津市藥品監督管理局關于優化境外醫療器械產品遷入我市有關審批事項的通知(試行) | 2022-06-29 | 天津市藥品監督管理局 https://scjg.tj.gov.cn/tjsscjdglwyh_52651/tjyj/XWDT149660/GZTZ149685/202206/t20220630_5922294.html | |
關于優化境外醫療器械產品遷入我市有關審批事項的通知》政策解讀 | 2022-07-01 | 天津市藥品監督管理局 | |
河南 | 河南省藥品監督管理局印發關于促進我省生物醫藥產業高質量發展的措施的通知
| 2021-03-21 | 河南省藥品監督管理局 |
湖南 | 湖南省藥品監督管理局關于印發《醫療器械技術審評提質增效行動方案》的通知(湘藥監發〔2021〕30號) | 2021-09-02 | 湖南省藥品監督管理局 http://mpa.hunan.gov.cn/mpa/xxgk/tzgg/wjtz/202109/t20210902_20456060.html |
湖南省藥審中心為外省來湘企業提供精準技術咨詢(一)、(二) | 2022-09-09 2022-09-12 | (一)http://mpa.hunan.gov.cn/mpa/yszx/tpxw1/201909/t20190909_13968868.html (二)http://mpa.hunan.gov.cn/mpa/xxgk/gzdt/sjdt/201909/t20190912_5483261.html | |
山東 | 《關于促進醫療器械產業高質量發展的十六條措施》 | 2022-05-13 | 山東省藥品監督管理局 http://mpa.shandong.gov.cn/art/2022/5/13/art_101747_10324524.html |
政策解讀:《關于促進醫療器械產業高質量發展的十六條措施》 | 2022-05-13 | 山東省藥品監督管理局 http://mpa.shandong.gov.cn/art/2022/5/13/art_267473_10331163.html | |
廣東 | 廣東省藥品監督管理局辦公室關于印發廣東省藥品監督管理局關于優化第二類醫療器械注冊審評審批的若干措施的通知 | 2022-05-23 | 廣東省藥品監督管理局-工作文件 |
關于已上市第二類醫療器械遷入我省注冊申報指引(試行) | 2022-08-29 | 廣東省藥品監督管理局-通知公告 | |
湖北 | 深入開展“下基層察民情解民憂暖民心”實踐活動 進一步優化第二類醫療器械注冊審評機制的若干措施 | 2022-05-27 | 湖北省藥品監督管理局 http://mpa.hubei.gov.cn/zfxxgk/zc/qtzdgkwj/qtwj/202205/t20220527_4148687.shtml |
江蘇 | 江蘇省藥品監督管理局同一集團已取得第二類醫療器械注冊證產品來蘇申報注冊工作指南(試行) | 2022-06-30 | 江蘇省藥品監督管理局 http://da.jiangsu.gov.cn/art/2022/6/30/art_65298_10525240.html |
貴州 | 省藥品監管局關于印發《關于優化貴州省第二類醫療器械審評審批的若干措施》的通知 | 2022-07-01 | 貴州省藥品監督管理局 http://yjj.guizhou.gov.cn/zwgk/gzhgfxwjsjk/gfxwjsjk/202207/t20220701_75363680.html |
《關于優化貴州省第二類醫療器械審評審批的若干措施》政策解讀 | 2022-07-04 | 貴州省藥品監督管理局 http://yjj.guizhou.gov.cn/jdhy/zcjd/wzjd/202207/t20220704_75381940.html | |
遼寧 | 遼寧省藥品監督管理局境內第二類醫療器械優先注冊程序 | 2022-07-05 | 遼寧省藥品監督管理局-意見征集 http://ypjg.ln.gov.cn/hdjl_133062/zqyj/202207/t20220705_4608368.html |
云南 | 省藥監局出臺 20 條措施促進醫療器械產業高質量發展 | 2022-07-22 | 云南省藥品監督管理局 http://mpa.yn.gov.cn/newsite/NewsView.aspx?ID=a358264a-f2ea-4003-a89f-20c4e6a59882 |
江西 | 優化營商環境 促進醫療器械產業高質量發展“十三條”惠企政策 | 2022-09-13 | 【附件】:同一集團、同一法人已取得第二類醫療器械注冊證產品來贛申報注冊實施細則 http://mpa.jiangxi.gov.cn/art/2022/9/14/art_35392_4141841.html |