自保健食品備案信息系統于2017年5月1日正式上線運營起,截止2021年2月22日,公開已取得備案的進口保健食品有123款(因有些已備案產品還未公開,因此實際更多)。受限于備案類保健食品的劑型需符合《保健食品備案產品主要生產工藝(試行)》等法規的要求,目前僅以下劑型允許用于備案保健食品:片劑、硬膠囊、軟膠囊、口服液和顆粒劑。
眾所周知,保健食品備案制是前所未有的,這一政策大大縮短了行政審批流程,也減輕了企業負擔。國家市場監督管理總局(原CFDA)為了進一步響應簡政放權的政策,勢必需要有更多的保健食品符合備案制度。為了擴大保健食品備案產品劑型,市場監管總局于2021年2月20日正式發布了《保健食品備案產品劑型及技術要求(2021年版)》以及配套修訂的《保健食品備案可用輔料及其使用規定(2021年版)》(下稱“21版輔料目錄”),將凝膠糖果和粉劑納入保健食品備案劑型,并將于2021年6月1日起施行。
與目前可用劑型不同,此次納入備案的凝膠糖果和粉劑屬于食品形態。為了幫助企業更加直觀的了解到中國保健食品備案相關法規要求,此文以凝膠糖果形態的進口保健食品為例,重點介紹進口保健食品的備案流程,備案所需證明文件和資料要求,以及備案工作的注意事項。
進口保健食品備案流程簡圖
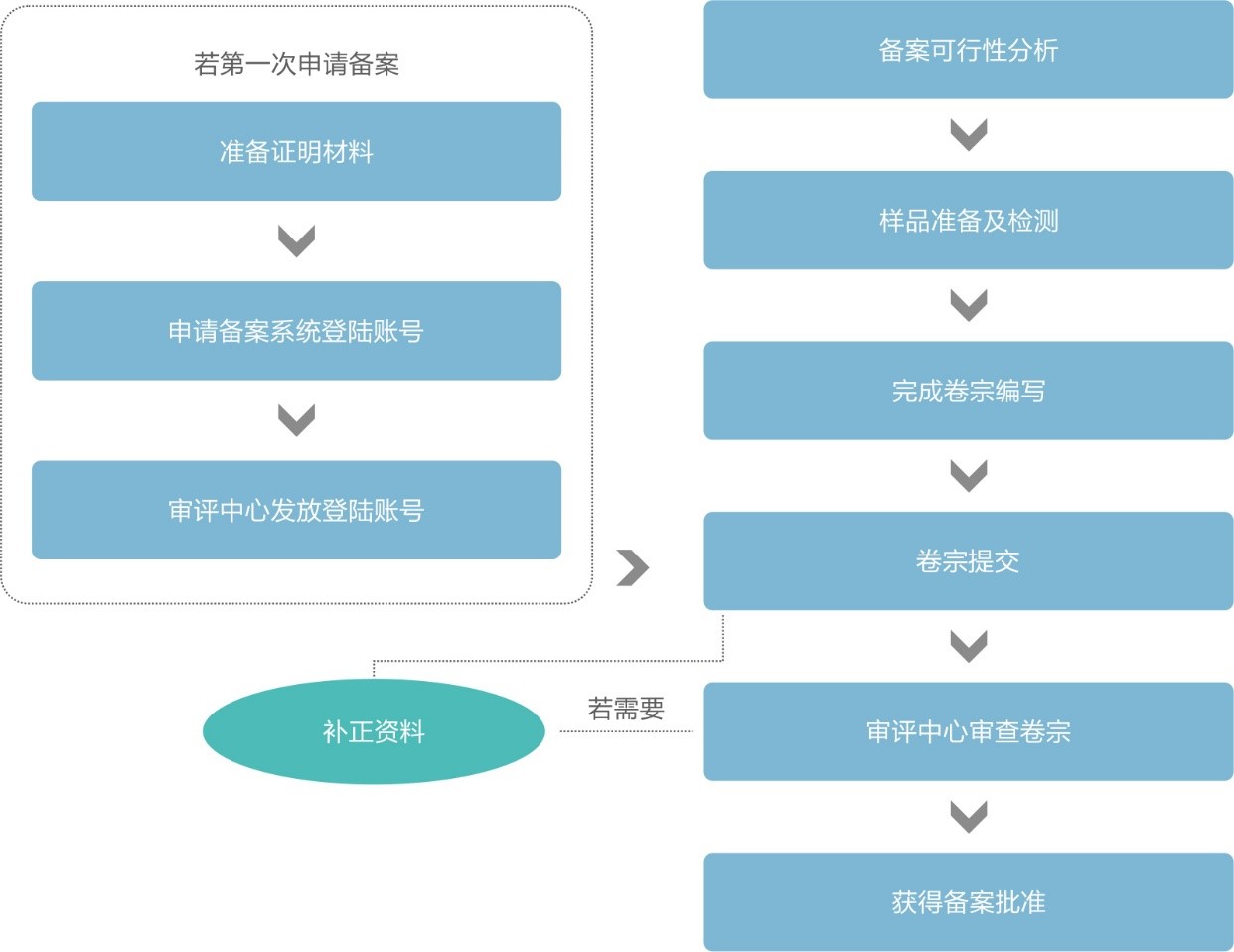
上圖為保健食品備案賬號申請和產品備案申請的流程簡圖。如圖所示,進口保健食品首次備案(提交卷宗)前,備案人需要先獲取備案管理信息系統登錄賬號(以下簡稱“備案賬號”)。獲取備案賬號后,才能進行產品備案卷宗的線上提交。通常在一切順利的情況下,從資料準備到最終拿到產品備案憑證,整個周期為8個月左右,其中比較耗時的是:證明文件的開具,樣品的穩定性測試,官方的技術審評,補正和再次技術審評。通常為了縮短備案周期,瑞旭集團建議備案賬號的申請和保健食品備案的申請同時準備,一旦獲取備案賬號,即刻線上提交產品備案申請是最為快速的操作。另外,有些工作,比如樣品的測試和資料(包括證明文件)的準備也是可以同時進行的,這樣可以進一步壓縮申報的周期。
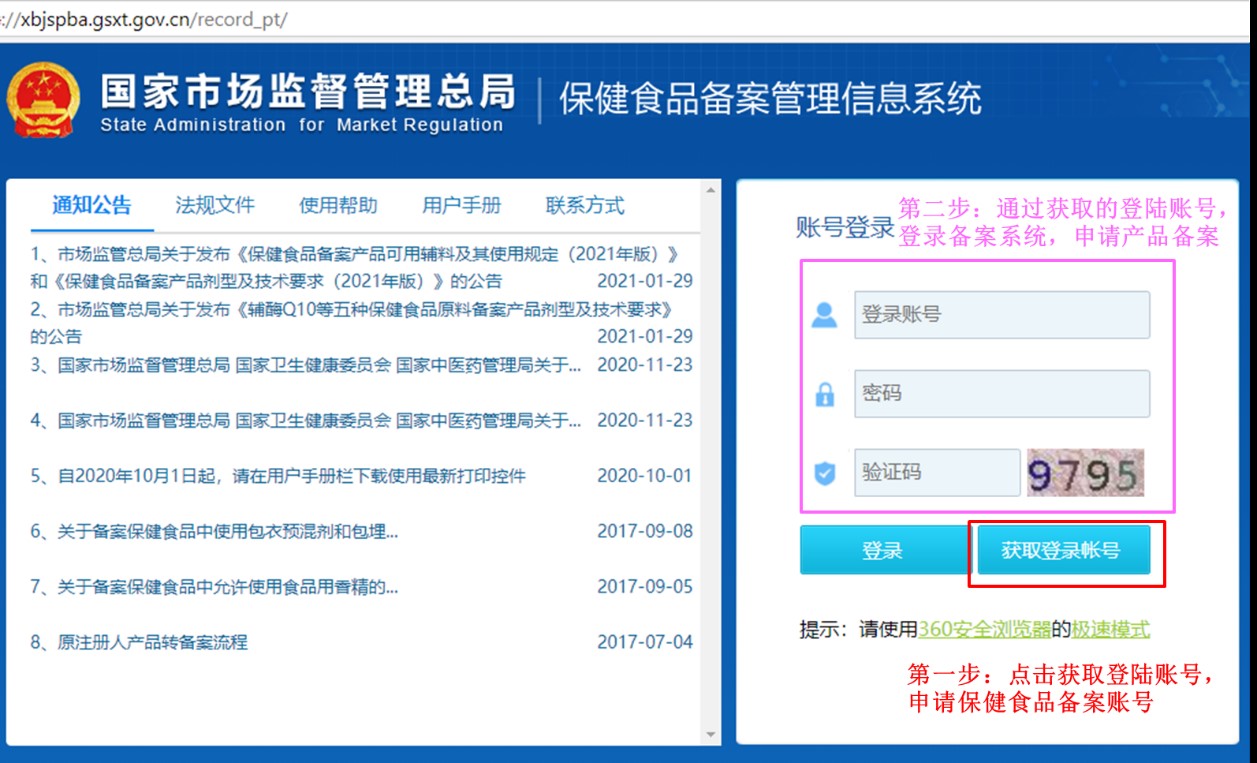
企業備案賬號的申請和產品備案的申請,首先需通過官方網站(保健食品備案管理信息系統)進行線上提交,審核通過后再線下提交紙質資料。線上第一步:點擊獲取登陸賬號,申請保健食品備案賬號。線上第二步:通過獲取的登陸賬號,登陸備案系統,申請保健食品的備案憑證。保健食品備案管理信息系統的網站首頁如下:
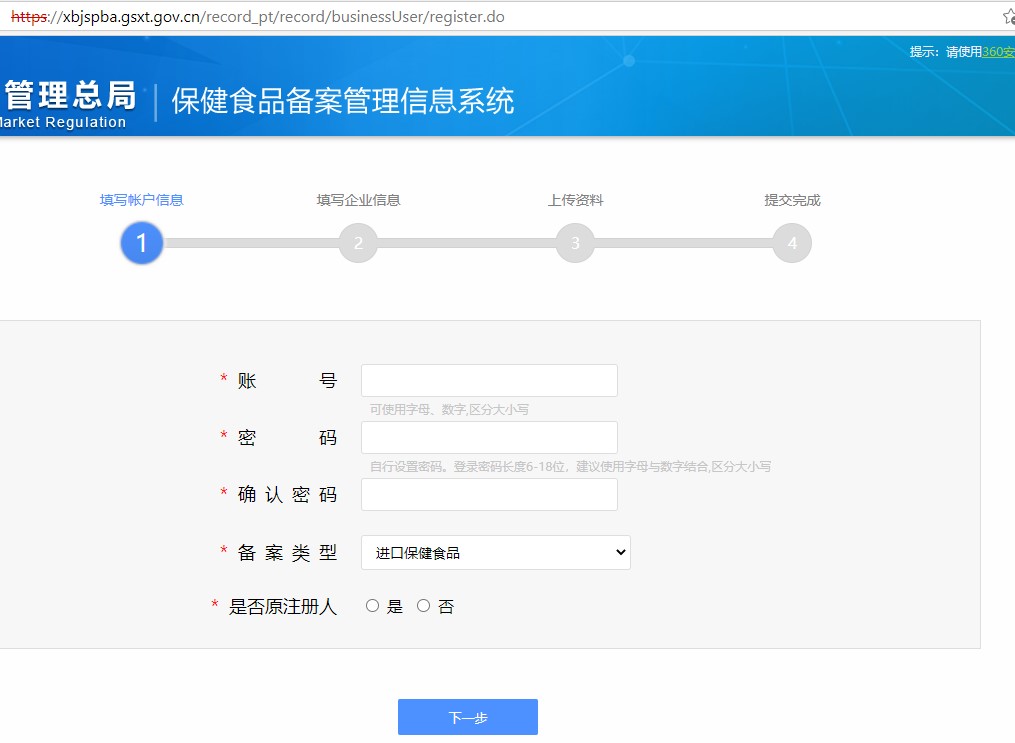
第一步:點擊獲取登陸賬號后,進入如下頁面,按要求填寫企業信息和上傳相關的證明文件,即可申請備案賬號。
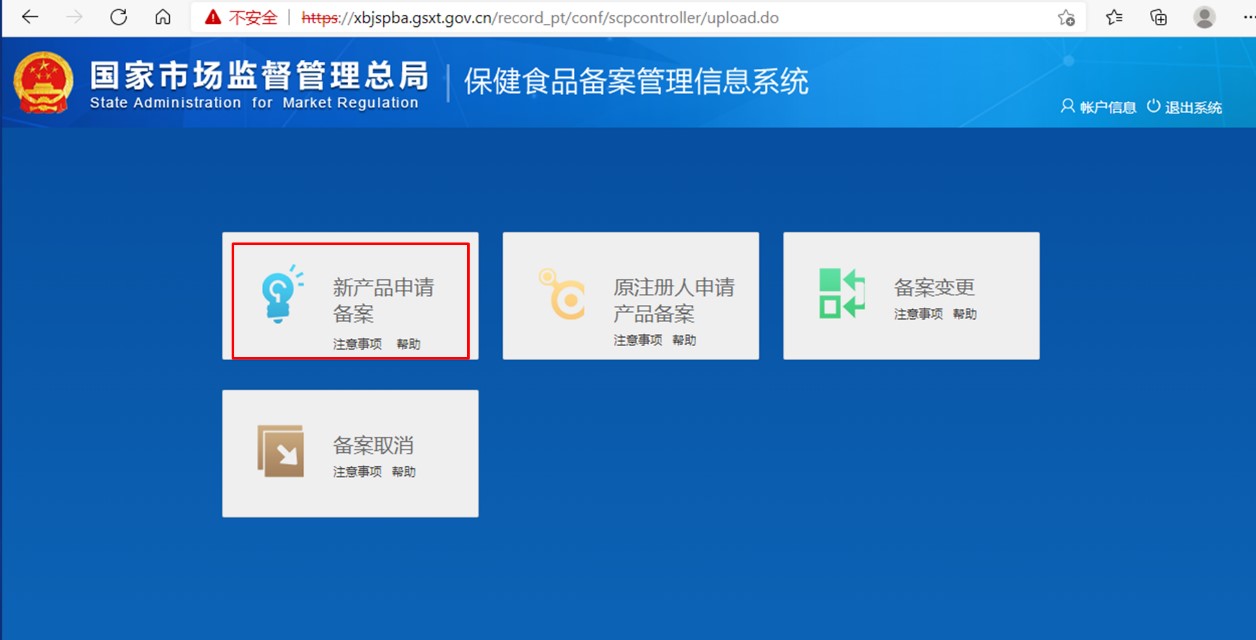
第二步:通過獲取的登陸賬號,登陸備案系統,進入如下頁面。點擊“新產品申請備案”,再點擊“備案申請”,按要求填寫產品信息,生產企業信息和境內申報機構信息,并上傳產品附件資料,即可申請保健食品的備案憑證。
無論是劑型為片劑、硬膠囊、軟膠囊、口服液或顆粒劑的保健食品,還是為凝膠糖果或粉劑的保健食品,其進口保健食品的備案流程都是一樣的。企業除了需要清楚了解到保健食品的備案流程,保健食品企業備案賬號的申請和保健食品產品備案憑證的申報所需要的證明文件和相關材料也是非常需要關注的。若材料準備不符要求,備案流程就會被打亂,甚至重頭開始。下面,瑞旭集團根據法規要求和實操經驗,整理了相關的材料要求,并列舉一些實際申報過程中應注意的點。
首先,關于備案人備案賬號的申請,所需的證明文件如下:
1. 產品生產國(地區)政府主管部門或法律服務機構出具的備案人為上市保健食品境外生產廠商(符合其所在國(地區)上市要求的法人或其他組織)的資質證明文件
2. 保健食品備案賬號申請聯系人授權委托書
3. 備案人法人代表的護照掃描件
以上的三個文件看似簡單,實則也有許多細節需要注意,比如護照掃描件必須要清晰完整,且是彩色的;聯系人授權委托書中如有法人代表的簽字,簽字必須和護照簽字統一。
再者,關于進口保健食品備案申請,又需要準備哪些材料和證明文件?
1.保健食品備案登記表,以及備案人對提交材料真實性負責的法律責任承諾書
2.備案人主體登記證明文件(國產保健食品:營業執照,保健食品生產許可證等。進口保健食品:產品生產國(地區)政府主管部門或者法律服務機構出具的備案人為上市保健食品境外生產廠商的資質證明文件)
3. 產品配方材料:產品配方表
4.產品生產工藝材料,包括生產工藝簡圖及說明
5. 安全性和保健功能評價材料
5.1 三批中試以上規模工藝生產的產品功效成分或標志性成分、衛生學、穩定性檢驗報告
5.2 原料、輔料合理使用的說明,及標簽說明書、產品技術要求制定符合相關法規的說明
6. 直接接觸保健食品的包裝材料種類、名稱、相關標準
7. 產品標簽說明書樣稿
8.產品技術要求材料
9. 具有合法資質的檢驗機構出具的符合產品技術要求全項目檢測報告
9.1食品檢驗機構的資質證明文件
9.2三批符合產品技術要求的全項目檢驗報告
10.產品名稱相關檢索材料
11.其他表明產品安全性和保健功能的材料
進口保健食品備案額外需要準備的材料
12.備案人主體登記證明文件(產品生產國(地區)政府主管部門或者法律服務機構出具的備案人為上市保健食品境外生產廠商的資質證明文件)
13. 備案產品上市銷售一年以上證明文件(產品生產國(地區)政府主管部門或者法律服務機構出具的保健食品類似產品上市銷售一年以上的證明文件,或者產品境外銷售以及人群食用情況的安全性報告)
14. 產品生產國(地區)或者國際組織與保健食品相關的技術法規或者標準原文,保證生產質量管理體系有效運行的自查報告,符合良好生產質量管理規范的證明文件
15.產品生產國(地區)上市的包裝、標簽、說明書實樣、中文譯本及公證書
16.由境外備案人常駐中國代表機構辦理備案事務的,應當提交《外國企業常駐中國代表機構登記證》及其復印件。境外備案人委托境內的代理機構辦理備案事項的,應當提交經過公證的委托書原件以及受委托的代理機構營業執照復印件
這里需要注意,目前可用的備案產品劑型(片劑、硬膠囊、軟膠囊、口服溶液、顆粒劑)均為現行《中國藥典》中收載的劑型,技術要求中指標設定參考現行《中國藥典》和《食品安全國家標準 保健食品》(GB16740)。而此次納入備案的凝膠糖果和粉劑屬于食品形態,其技術指標無相應的國家標準,同時,其在備案時可用的輔料與現有的備案產品劑型也不完全相同。因此法規對兩類產品的技術要求、可用輔料等均做出了特定或額外要求。
下文以凝膠糖果形態的保健食品為例,具體說明該形態產品的技術要求和可用輔料等重要內容。
凝膠糖果概述:
用于保健食品備案的凝膠糖果是以納入保健食品原料目錄的原料,與食糖或糖漿或甜味劑、食用膠(或淀粉)等輔料,經相關工藝制成具有彈性和咀嚼性的糖果。
凝膠糖果產品說明書有關重點內容:
說明書中的內容 | 相關要求 |
適宜人群 | 4歲以上人群 |
食用量及食用方法 | 每日最大食用量為20g;食用方法為“應充分咀嚼后服用”。 |
規格 | 每粒不超過6g |
注意事項 | 請勿吞服。食用本產品的人群應當具備有咀嚼固體食物的能力。同時對于適宜人群含有“13歲以下”的,建議增加“應在成人監督下充分咀嚼食用”的提示。 |
凝膠糖果產品技術要求:
產品技術要求根據凝膠糖果食品的特點,對凝膠糖果類產品的感官要求、理化指標、微生物指標均做出了具體規定(不涉及產品使用的原料輔料在制成產品時還需要符合的其他規定)。以理化指標為例,要求如下:
項 目 | 指 標 |
鉛(以Pb計),mg/kg | ≤0.5 |
總砷(以As計),mg/kg | ≤0.5 |
總汞(以Hg計),mg/kg | ≤0.3 |
干燥失重,g/100g | 植物膠型:≤18.0 動物膠型:≤20.0 淀粉型:≤18.0 混合型:≤35.0 夾心型、包衣和包衣拋光型:符合主體糖果的要求 其他膠型:≤20.0 |
還原糖(以葡萄糖計), g/100g | ≥10.0 夾心型、包衣和包衣拋光型:符合主體糖果的要求。 無糖膠型凝膠糖果不設該指標。 |
單糖和雙糖,g/100g | ≤0.5,僅無糖膠型凝膠糖果設定該指標 |
凝膠糖果主要生產工藝:
溶膠、化糖、熬煮、混合、調配、過濾、充氣、成型、干燥、拌砂、包衣、拋光、涂掛、包裝等。
凝膠糖果的使用范圍:
目前,已納入保健食品原料目錄中的維生素礦物質為原料的產品可以使用凝膠糖果食品形態。
凝膠糖果可用輔料及相關要求:
1. 凝膠糖果可用輔料
21版輔料目錄中共包括197個輔料。由于凝膠糖果和粉劑屬于食品形態,對可用于凝膠糖果和粉劑的輔料進行了進一步的篩選。以凝膠糖果為例,可用于凝膠糖果的輔料共151個,不可用輔料包括使用標準僅為藥品標準的輔料(保留“純化水”)、糖果中不可用的輔料等,具體如下所示:β-環狀糊精、丁基羥基茴香醚(BHA)、對羥基苯甲酸酯類及其鈉鹽(對羥基苯甲酸甲酯鈉,對羥基苯甲酸乙酯及其鈉鹽)、二丁基羥基甲苯(BHT)、二氧化硅、富馬酸、紅曲黃色素、滑石粉、環己基氨基磺酸鈉、抗壞血酸棕櫚酸酯、硫酸鈣、迷迭香提取物、羧甲基淀粉鈉、糖精鈉、維生素E、鹽酸、異構化乳糖液、乙酸鈉、硬脂酸鈣、單糖漿、低取代羥丙纖維素、黑氧化鐵、紅氧化鐵、糊精、黃氧化鐵、交聯聚維酮、交聯羧甲纖維素鈉、聚維酮K30、聚乙二醇、可溶性淀粉、羥丙纖維素、甘油三乙酯、無水磷酸氫鈣、乙基纖維素、預膠化淀粉、蔗糖、棕氧化鐵、明膠空心膠囊、共聚維酮、聚乙烯吡咯烷酮、麥芽糊精、異麥芽酮糖醇、枸櫞酸、無水枸櫞酸、大豆磷脂、羥丙基淀粉空心膠囊。
2. 輔料可用的質量標準
凝膠糖果備案時不得使用以下24個輔料中的藥品標準:阿拉伯膠、D-甘露糖醇、二氧化鈦、蜂蠟、甘油、甲基纖維素、明膠、木糖醇、羥丙基甲基纖維素、三氯蔗糖、山梨酸及其鉀鹽(以山梨酸計)、山梨糖醇和山梨糖醇液、羧甲基纖維素鈉、天門冬酰苯丙氨酸甲酯(又名阿斯巴甜)、微晶纖維素、硬脂酸鎂、馬鈴薯淀粉、木薯淀粉、乳糖、食用葡萄糖、食用小麥淀粉、食用玉米淀粉、薄荷腦、碳酸鎂。
3. 輔料可用的用量
21版輔料目錄中有15個輔料額外列出了在凝膠糖果中的生產允許使用量,包括:苯甲酸及其鈉鹽(以苯甲酸計)、赤蘚紅及其鋁色淀(以赤蘚紅計)、二氧化鈦、紅花黃、聚甘油脂肪酸酯、葡萄皮紅、甜菊糖苷、莧菜紅及其鋁色淀(以莧菜紅計)、胭脂紅及其鋁色淀(以胭脂紅計)、葉綠素銅鈉鹽、乙酰磺胺酸鉀、硬脂酸、梔子黃、梔子藍、辛,癸酸甘油酯。
通過以上的保健食品備案流程和備案所需資料來看,實則保健食品備案的技術要求并不是特別高。相對保健食品注冊來說,備案無需進行毒理試驗、功能試驗,也無需研發報告等資料。但是對于進口保健食品企業來說,保健食品備案賬號的申請和產品的備案申請還是會面臨以下幾個難點:
- 對法規的透徹理解:保健食品備案相關的法規較多,內容也較為豐富,只有對法規非常熟悉的技術人員才能做到全面理解,盡可能的少走彎路。
- 有豐富的實操經驗:瑞旭集團發現在準備企業備案賬號和產品備案憑證的申報資料時,除了法規中的細節要求,有些不成文要求可能沒法在法規中量化或說明,只有經常和審評老師溝通,具有相關備案經驗的技術人員才能了解到這些細節問題,能精準把握尺度。
- 對法規政策的實時跟蹤:法規中大部分內容的要求是不會變化的,但是對于一些細節問題的要求,審評專家會根據他們的評估監測,不定期的細化。另外法規也有可能不斷在更新。以瑞旭集團舉例,食品事業部有專門的人員監測法規的變動并通知所有人,任何技術人員在處理新項目時,若發現評審專家的要求有變化,也會通知給部門所有人,以此來避免下個項目走彎路。
- 對企業聯系人的要求:聯系人必須擁有中國手機號碼,且會說中文。另外聯系人至少在一定程度上對保健食品法規和提交的資料了解,因為聯系人需要接聽審評老師的電話,并與審評老師溝通解釋,以在一定程度上減少補正的可能性,讓項目更為順利。
以上幾個難點,進口保健食品企業若要攻克,需要花費不少精力和財力。因此絕大部分的進口備案類保健食品企業選擇委托境內的代理機構辦理備案事項。瑞旭集團可提供保健食品注冊和保健食品備案服務,企業若有任何需要,歡迎隨時聯系我們。
相關鏈接:
我們的服務:
