背景
2020年12月1日,國家市場監督管理總局會同國家衛生健康委員會、國家中醫藥管理局制定并發布了輔酶Q10等五種保健食品原料目錄(以下簡稱《原料目錄》)。自此,以2020年12月1日為時間節點,對于使用輔酶Q10等五種原料的保健食品:在《原料目錄》發布后(即2020年12月1日之后)提出申請的單方國產產品應申請保健食品備案,進口產品仍需申請保健食品注冊;而對于在《原料目錄》發布前(即2020年12月1日之前)受理的國產和進口注冊申請,以及已獲得注冊的保健食品,需要進行注冊轉備案申請。
為什么要選擇申請注冊產品轉備案,而不是以新產品的身份直接申請備案?
國產保健食品:注冊轉備案不是唯一選擇,但存在利好政策
作為國產保健食品,以輔酶Q10等五種原料的單方新產品可以直接申請備案。因此,國產的此類產品,既可以放棄注冊產品的身份,完全作為新產品去申報保健食品備案,也可以選擇申請注冊轉備案。
選擇注冊轉備案的優點在于部分轉備案產品不需要重新進行產品功效成分、衛生學、穩定性試驗(該利好政策同樣適用于轉備案的進口保健食品),大大縮短了申報周期。
- 已獲得注冊證書的保健食品申請轉為備案時,原輔料或用量及技術要求如果沒有發生改變的,產品的檢驗報告只需要提交全項目檢驗報告,而不需要提交產品功效成分、衛生學、穩定性檢驗報告;
- 《原料目錄》發布前已受理注冊申請的保健食品申請轉為備案時,原輔料或用量及技術要求如果沒有發生改變的,產品功效成分、衛生學、穩定性檢驗報告可以直接使用注冊申報時提交的檢驗報告,同時提供全項目檢驗報告。
進口保健食品:注冊轉備案是唯一選擇
- 以輔酶Q10等五種原料的單方新產品備案僅針對國產保健食品,不包括首次進口的保健食品。換言之,以輔酶Q10等五種原料的進口新產品無法申請備案,只能申請注冊。
- 對于已經獲得注冊證書的此類單方產品,無法申請延續注冊,而是應該在注冊證書有效期前申請注冊轉備案。
- 對于《原料目錄》發布前已經受理注冊申請的進口保健食品,使用原料目錄以內原料的,也應該申請注冊轉備案。
申請注冊產品轉備案包括兩大步驟:1)獲得原注冊人資質;2)申請產品備案。具體內容如下:
獲得原注冊人資質
在申請注冊產品轉備案前,應先獲得原注冊人資質,哪些情況可以申請原注冊人資質?
- 已受理的保健食品:《原料目錄》發布前受理的以輔酶Q10、魚油、褪黑素、破壁靈芝孢子粉和螺旋藻為原料的單方產品注冊申請(包括新產品注冊、延續注冊、變更注冊和轉讓技術注冊),并且產品符合備案相關技術要求的,可以作為原注冊人;
- 已獲得注冊的保健食品:以輔酶Q10、魚油、褪黑素、破壁靈芝孢子粉和螺旋藻為原料的單方產品,且符合備案相關技術要求的,可以作為原注冊人。
- 《原料目錄》發布前受理的保健食品注冊申請,以及獲得注冊的保健食品,其部分原料或用量不符合《原料目錄》以及備案技術要求的,注冊申請人或證書持有人同意按照《原料目錄》調整產品原料和產品技術要求,也可以作為原注冊人。
原注冊人資質的申請流程
- 已獲得注冊的產品:

申請流程具體說明:
1) 注冊申請人在保健食品注冊管理系統中按變更注冊要求提出“注冊轉備案”變更申請;
2) 獲得國家市場監督管理總局確認原注冊人資質的《審評意見通知書》;
- 《原料目錄》發布之前受理的新產品注冊、延續注冊、變更注冊和轉讓技術注冊,申請人可選擇以下2種途徑獲得原注冊人資質:
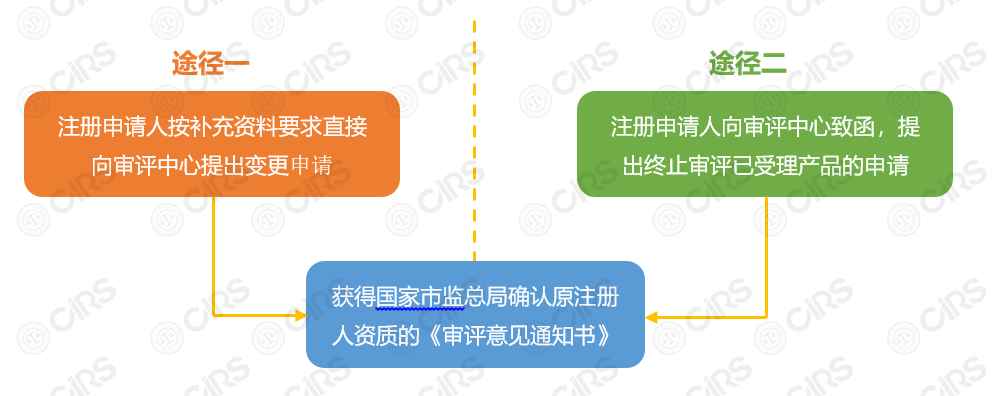
申請流程具體說明:
1) 注冊申請人可選擇途徑一或途徑二獲得原注冊人資質,具體為:
途徑一:注冊申請人按補充資料要求直接向審評中心提出變更申請;
途徑二:注冊申請人向審評中心致函,提出終止審評已受理產品的申請。
2) 獲得國家市場監督管理總局確認原注冊人資質的《審評意見通知書》;
(備注:對于途徑一中的“補充資料”,一般是由審評中心向注冊申請人發出“補充資料”要求后,申請人按照要求提交補充資料,可在補充資料時提出注冊轉備案申請。對于符合備案要求的產品,審評中心一般不再要求補充資料,而是直接出具《未獲批準通知書》,拿到該通知書時,注冊人即獲得原注冊人資質。采用途徑一時,需要等待審評中心出具的意見通知書,申請人的處境較為被動。)
原注冊人資質的申請資料要求(已獲得注冊的產品)
國產保健食品
1) 國產保健食品變更注冊申請表及注冊申請人對申請材料真實性負責的法律責任承諾書;
2) 注冊申請人主體登記證明文件復印件;
3) 保健食品注冊證書及其附件的復印件;
4) 變更的注冊事項、理由和依據;
5) 注冊轉備案申請書。
進口保健食品
1) 進口保健食品變更注冊申請表及注冊申請人對申請材料真實性負責的法律責任承諾書;
2) 注冊申請人主體登記證明文件復印件;
3) 保健食品注冊證書及其附件的復印件;
4) 產品生產國(地區)政府主管部門或者法律服務機構出具的注冊申請人為上市保健食品境外生產廠商的資質證明文件;
5) 產品生產國(地區)政府主管部門或者法律服務機構出具的保健食品上市銷售一年以上的證明文件,或者產品境外銷售以及人群食用情況的安全性報告;
6) 出口國(地區)對產品實施批準的,應出具出口國(地區)主管部門準許上市銷售的證明文件;
7) 產品生產國(地區)或者國際組織與保健食品相關的技術法規或者標準原文;
8) 變更后的產品包裝、標簽、說明書實樣;
9) 由境外注冊申請人常駐中國代表機構辦理注冊事務的,提交《外國企業常駐中國代表機構登記證》及其復印件;境外注冊申請人委托境內的代理機構辦理注冊事務的,提交經過公證的委托書原件以及受委托的代理機構營業執照復印件;
10) 變更的具體事項、理由和依據;
11) 注冊轉備案申請書。
申請產品備案
- 國產保健食品:以原注冊人身份向備案管理部門提出備案管理信息系統登錄賬號申請(已有登錄賬號的除外)或產品備案申請。
- 進口保健食品:目前產品備案申請政策不明朗
根據國家市監總局食品審評中心2017年7月5日發布的問答“原注冊人產品轉備案應按何流程進行?”,獲得確認原注冊人資質的《審評意見通知書》后,以原注冊人身份提出備案賬號申請(已有登錄賬號的除外)和產品備案申請。但是,瑞旭集團發現進口保健食品備案系統中沒有關于“功能性保健食品”的申請入口。根據與審評中心專家的溝通,目前政府部門針對進口保健食品(以輔酶Q10等五種原料的產品)獲得原注冊人資質之后,如何申請產品備案仍在商討中。
瑞旭將持續關注以輔酶Q10等五種原料的進口保健食品轉備案的最新政策變動,對于已獲得注冊證書的進口產品,原注冊人資質申請時需要提供一系列的證明文件,申請人準備這些證明文件的周期一般較長,因此,瑞旭集團建議企業提前準備申請原注冊人資質,以確保進口產品轉備案政策確定后,能獲得率先入場的機會。
我們的服務:
